Chẩn đoán và điều trị một số bệnh liên quan đến cầu thận - KDIGO 2021
Trungtamthuoc.com - Bệnh cầu thận ngày càng xảy ra phổ biến, nhất là ở những người trẻ tuổi, do đó việc chẩn đoán sớm và tối ưu hóa việc quản lý để kiểm soát bệnh cũng như ngăn ngừa bệnh thận tiến triển là một vấn đề rất cấp thiết. Bài viết dưới đây sẽ giúp bạn đọc biết được cách chẩn đoán và điều trị một số bệnh cầu thận phổ biến trên lâm sàng.
Bệnh cầu thận (trừ bệnh thận đái tháo đường) chiếm khoảng 25% tổng số các trường hợp bệnh thận mạn (CKD) trên toàn cầu. Chiếm một tỉ lệ lớn các bệnh nhân có thời gian mắc bệnh kéo dài và đặc biệt là biểu hiện thường gặp ở những người trẻ tuổi, do đó điều quan trọng là bệnh phải được chẩn đoán sớm và tối ưu hóa việc quản lý để kiểm soát bệnh và ngăn ngừa bệnh thận tiến triển. Vì vậy năm 2021 KDIGO đã cho ra bản cập nhật mới về hướng dẫn thực hành quản lý bệnh cầu thận với một định dạng mới (đã được đề cập trong chương bệnh thận đái tháo đường). Nội dung của hướng dẫn này gồm 11 chương, tuy nhiên chúng tôi chỉ biên dịch một số chương trong giới hạn thực hành nội khoa và một số bệnh cảnh thường gặp trên lâm sàng cho sinh viên.
| Mức khuyến cáo | Ý nghĩa |
| Mức độ 1 "Khuyến cáo" | Hầu hết bệnh nhân nên được thực hiện theo khuyến cáo |
| Mức độ 2 "Đề xuất" | Có thể cần cá nhân hóa điều trị với mỗi bệnh nhân |
| Mức bằng chứng | Chất lượng bằng chứng | Ý nghĩa |
| A | Cao | Hiệu quả thực tế gần với ước tính |
| B | Vừa phải | Hiệu quả thực tế có thể gần với ước tính nhưng vẫn có khả năng khác biệt |
| C | Thấp | Hiệu quả thực tế có thể khác đáng kể so với ước tính |
| D | Rất thấp | Ước tính về hiệu quả là rất không chắc chắn, và thường khác biệt nhiều với hiệu quả thực tế. |
1 TÓM TẮT NHỮNG KHUYẾN CÁO VÀ QUAN ĐIỂM THỰC HÀNH
1.1 CHƯƠNG 1: NHỮNG ĐIỂM CHÍNH TRONG QUẢN LÝ BỆNH CẦU THẬN
1.1.1 Sinh thiết thận
Quan điểm thực hành 1.1.1: Sinh thiết thận là “tiêu chuẩn vàng" trong đánh giá chẩn đoán các bệnh cầu thận. Tuy nhiên, trong một số trường hợp, có thể điều trị mà không cần xác định chẩn đoán bằng sinh thiết thận (Hình 1)

ANCA, kháng thể kháng bào tương bạch cầu hạt trung tính; eGFR, mức lọc cầu thận ước tính; GN, viêm cầu thận; MPO, myeloperoxidase; PLA2Rab, Kháng thể kháng thụ thể phospholipase A2 dương tính type M; PR3, proteinase 3.
Quan điểm thực hành 1.1.2: Đánh giá mô thận sinh thiết cần đáp ứng các tiêu chuẩn theo yêu cầu (hình 2).

AA, amyloid A; GBM, màng đáy cầu thận; DNAJB9, phân họ Dnal homolog B thành viên thứ 9; GN, viêm cầu thận; IgA, immunoglobulin A; IgG, immunoglobulin G; IgM, immunoglobulin M; LECT2, bạch cầu có nguồn gốc từ tế bào chemotaxin-2; PLA2R, thụ the phospholipase tuýp M; THDS7A, thrombospondin thể I chứa miền 7A.
Quan điểm thực hành 1.1.3: Lặp lại sinh thiết thận nếu kết quả thu được có thể thay đổi kế hoạch điều trị hoặc có vai trò trong ước đoán tiên lượng bệnh
1.1.2 Đánh giá chức năng thận
Quan điểm thực hành 1.2.1: Ở những bệnh nhân mắc bệnh cầu thận cần được khởi trị hoặc tăng cường điều trị liệu pháp ức chế miễn dịch, hoặc có thay đổi tình trạng lâm sàng thì cần lấy nước tiểu 24 giờ để xác định tổng lượng protein bài xuất.
Quan điểm thực hành 1.2.2: Đối với trẻ em, lấy mẫu nước tiểu 24 giờ không lý tưởng vì nó có thể không chính xác và khó khăn. Thay vào đó, theo dõi tỷ protein-creatinine (PCR) ở mẫu nước tiểu đầu tiên vào buổi sáng.
Quan điểm thực hành 1.2.3: Vì bài tiết protein và creatinine thay đổi theo thời gian nên không khuyến cáo lấy mẫu nước tiều bất kỳ làm PCR.
Quan điểm thực hành 1.2.4: Lấy mẫu nước tiểu đầu tiên vào buổi sáng có thể đánh giá thấp hơn lượng protein bài tiết thực tế trong 24 giờ trong trường hợp protein niệu tư thế đứng.
Quan điểm thực hành 1.2.5: Nếu khả thi, có thể chấp nhận lấy mẫu nước tiểu "dự kiến" 24 giờ và định lượng PCR một phần của mẫu.
Quan điểm thực hành 1.2.6: Không cần thiết phải định lượng natri niệu đồng thời và thường quy khi xét nghiệm nước tiểu, trừ khi có lý do để nghi ngờ việc không tuân thủ chế độ ăn hạn chế natri. (Bảng 1 và Quan điểm thực hành 1.4.2 và 1.5.9)
Bảng 1. Đánh giá chức năng thận ở bệnh cầu thận
| Đo chức năng thận trực tiếp | Đo chức năng thận gián tiếp qua các công thức ước tính | Hạn chế |
| Độ thanh thải creatinine creatinine niệu 24 giờ | eGFR | • Không công thức ước tính nào xác định được chính xác chức năng thận ở bệnh nhân bệnh cầu thận và/hoặc hội chứng thận hư • Chủng tộc thường là một yếu tố làm nhiều • Ở các công thức dựa vào creatinine, giảm albumin máu có thể dẫn đến việc ước tính GFR cao hơn so với thực tế do tăng sự bài tiết creatinine ở ống thận • Glucocorticoid có thể làm tăng cystatin C huyết thanh, do đó có khả năng khiến eGFR thấp hơn thực tế • Khối lượng cơ thấp có thể khiến eGFR ước tính cao hơn thực tế khi dùng các công thức dựa vào creatinine • AKI làm nhiều ở tất cả các công thức ước tính và chỉ dùng được khi bệnh nhân ở trạng thái ổn định |
Tính GFR* - Độ thanh thải Inulin (tiêu chuẩn vàng) - Độ thanh thải đồng vị phóng xạ trong huyết tương 125lothalamate; 99mTc-DTPA; EDTA 51Cr- - Độ thanh thải chất không phải đồng vị phóng xạ trong huyết •lohexol | Người lớn - Cockcroft - Gault (140- tuổi). (cân nặng [kg]) x 0.85 (nếu là nữ) / creatinine huyết thanh (mg/dL) x 72 - Công thức MDRD (không đúng khi eGFR >60 ml/phút/1.73m²) - Công thức CKD-EPI creatinine tiên) Dùng được ngay cả khi eGFR >60 ml/phút/1.73m² - Công thức CKD-EPI- cystatin C (dùng được khi eGFR >60 ml/phút/1.73m²) - Công thức FAS Dùng được ngay cả khi eGFR >60 ml/phút/1.73m² ( | |
Trẻ em Công thức Schwartz và công thức Schwartz hiệu chỉnh • Công thức FAS |
* Đơn vị là ml/phút/1.73m². Hệ số hiệu chỉnh với chủng tộc trong các công thức ước tính GFR còn tranh cãi, và thảo luận về chủ đề này vẫn còn tiếp tục. Tham khảo hướng dẫn KDIGO về Bệnh thận mạn (CKD) để biết thêm thông tin.
Quan điểm thực hành 1.2.7: Định lượng protein niệu trong bệnh cầu thận thích hợp một cách cụ thể đến tiên lượng và ra quyết định điều trị. Định tính protein niệu có thể có ích trong một số trường hợp.
Quan điểm thực hành 1.2.8: Đối với trẻ em, đích điều trị bệnh là như nhau với các nguyên nhân khác nhau. Mục tiêu cho bất kỳ trẻ nào mắc bệnh cầu thận: tỷ PCR < 200mg/g (<20 mg/mmol) hay <8 mg/m²/giờ ở mẫu nước tiểu 24 giờ nên. Chấp nhận ngưỡng cao hơn chỉ trong trường hợp có bằng chứng sẹo thận trên sinh thiết.
Quan điểm thực hành 1.2.9: Ưu tiên sử dụng công thức CKD-EPI để ước tính mức lọc cầu thận (eGFR) dựa trên creatinine ở người lớn mắc bệnh cầu thận, và công thức Schwartz hiệu chỉnh ưu tiên cho trẻ em. Công thức FAS có thể được sử dụng ở cả người lớn và trẻ em (Bảng 1).
1.1.3 Đánh giá tiểu máu
Quan điểm thực hành 1.3.1: Chỉ định ở tất cả các thể bệnh cầu thận với đánh giá thường quy cặn nước tiểu để quan sát hình thái của hồng cầu và sự xuất hiện của trụ hồng cầu và/hoặc hồng cầu gai (acanthocytes).
Quan điểm thực hành 1.3.2: Theo dõi tiểu máu (mức độ và sự kéo dài) có thể có giá trị tiên lượng ở rất nhiều thế của bệnh cầu thận. Điều này đặc biệt áp dụng cho bệnh thận IgA (IgAN) và viêm mạch IgA.
1.1.4 Quản lý các biến chứng của bệnh cầu thận (bảng 2)
Bảng 2. Quản lý phù trong hội chứng thận hư
| Quan điểm thực hành 1.4.1: Sử dụng thuốc lợi tiểu quai như là liệu pháp đầu tay để điều trị phù do hội chứng thận hư | - Ưu tiên dùng 2 lần/ngày hơn 1 lần/ngày; liều hàng ngày có thể được chấp nhận trong trường hợp giảm GFR - Tăng liều lợi tiểu quai cho đến khi gây lợi niệu đáng kể trên lâm sàng hoặc đạt đến liều tối đa có hiệu quả - Chuyển sang lợi tiểu quai tác dụng kéo dài như bumetanide hoặc torsemide/torasemide nếu lo ngại về thất bại khi điều trị với Furosemide, hoặc lo ngại về Sinh khả dụng của thuốc uống |
| Quan điểm thực hành 1.4.2: Hạn chế natri trong chế độ ăn | - Hạn chế natri trong chế độ ăn < 2.0 g/ngày (<90 mmol/ngày) |
| Quan điểm thực hành 1.4.3: Sử dụng thuốc lợi tiểu quai phối hợp với các thuộc lợi tiểu khác có cơ chế hiệp đồng trong điều trị phù kháng trị ở bệnh nhân hội chứng thận hư. | - Tất cả các lợi tiểu giống thiazide ở liều cao đều có hiệu quả tương đương nhau (không ưu tiên thuốc nào). - Thuốc lợi tiểu thiazide: dùng cùng với thuốc lợi tiểu quai đường uống hoặc tiêm tĩnh mạch sẽ làm giảm tái hấp thu natri ở ống lượn xa và tăng đáp ứng lợi niệu. - Amiloride có thể giúp cải thiện phù/tăng huyết áp, và đảo ngược tình trạng hạ Kali máu gây ra bởi lợi tiểu quai hoặc lợi tiểu thiazide - Acetazolamide có thể có ích trong trường hợp kiểm chuyển hoá do lợi tiểu - Spironolactone có thể giúp cải thiện phù/tăng huyết áp, và chống lại tình trạng hạ kali máu gây ra bởi lợi tiểu quai hoặc lợi tiểu thiazide |
| Quan điểm thực hành 1.4.4. Theo dõi các tác dụng phụ của thuốc lợi tiểu | - Hạ natri máu với thuốc lợi tiểu thiazide - Hạ kali máu với thuốc lợi tiểu quai và lợi tiểu thiazide - Giảm GFR - Giảm thể tích tuần hoàn, đặc biệt với bệnh nhân là trẻ em/người cao tuổi - Tăng kali với spironolactone và eplenerone đặc biệt khi kết hợp với thuốc ức chế hệ RAA |
| Quan điểm thực hành 1.4.5. Chiến lược cho bệnh nhân kháng thuốc lợi tiểu | - Amiloride - Acetazolamide - Lợi tiểu quai đường tĩnh mạch đơn trị (bolus hoặc truyền) - Lợi tiểu quai đường tĩnh mạch phối hợp với albumin đường tĩnh mạch - Siêu lọc - Lọc máu - Amiloride có thể giảm lượng kali mắt và tăng lợi tiểu. Acetazolamide có thể giúp điều trị kiếm chuyển hoá nhưng là một thuốc lợi tiểu yếu |
1.1.5 Quản lý tăng huyết áp và giảm protein niệu ở bệnh cầu thận
Bảng 2. Quản lý tăng huyết áp và protein niệu ở bệnh cầu thận.
| Quan điểm thực hành 1.5.1: Ở bệnh nhân mắc tăng huyết áp và protein niệu thì liệu pháp đầu tay với ACEi hoặc ARB, đến liều tối đa có thể dung nạp hoặc liều cho phép. | - Không ngưng ACEi hoặc ARB trong trường hợp creatinine máu tăng nhẹ và ổn định (có thể chấp nhận creatinin máu tăng lên đến 30%) - Ngưng ACEi hoặc ARB nếu chức năng thận tiếp tục kém, và/hoặc tăng kali máu kháng trị - Phối hợp ACEi và ARB có thể được dùng ở những bệnh nhân trẻ tuổi không mắc đái tháo đường hoặc bệnh tim mạch, nhưng lợi ích và độ an toàn chưa rõ Cảnh báo: không bắt đầu với ACEI/ARB ở những bệnh nhân đột ngột khởi phát hội chứng thận hư. Những thuốc này có thể gây tổn thương thận cấp đặc biệt ở những bệnh nhân có bệnh cầu thận thể thay đổi tối thiểu. |
| Quan điểm thực hành 1.5.2: Mục tiêu huyết áp tâm thu ở đa số bệnh nhân trưởng thành là < 120 mmHg khi đo huyết áp phòng khám tiêu chuẩn. Mục tiêu huyết áp trung bình 24 giờ ở trẻ em là s bách phân vị 50th theo tuổi, giới, và chiều cao và được đo bằng máy theo dõi huyết áp lưu động (ABPM) | - Tham khảo Hướng dẫn của KDIGO về huyết áp trong bệnh thận mạn - Nói một cách chính thức thì huyết áp tâm thu <120 mmHg chưa được chấp nhận đối với viêm cầu thận. Trong thực hành lâm sàng, chúng ta có thể đạt mức huyết áp tâm thu 120-130 mmHg ở hầu hết bệnh nhân có bệnh cầu thận |
| Quan điểm thực hành 1.5.3: Ở bệnh nhân viêm cầu thận và protein niệu đơn | độc, tăng liều ACEi hoặc ARB đến liều tối đa có thể dung nạp hoặc liều cho phép hàng ngày như là liệu pháp đầu tay điều tri | - Chỉ định cho trường hợp protein niệu dai dẳng dù đã điều trị viêm cầu thận tiên phát với thuốc ức chế miễn dịch (khi được chỉ định). - Tránh sử dụng ACEi hoặc ARB khi chức năng thận biến đổi nhanh |
| Quan điểm thực hành 1.5.4: Mục tiêu protein niệu thay đổi tuỳ thuộc vào diễn biến bệnh nguyên phát; thường <1 g/ngày | - Nên trì hoãn khởi trị ACEi và ARB ở những bệnh nhân không tăng huyết áp có bệnh lý tế bào chân (MCD, SSNS, hay FSGS tiên phát) với kỳ vọng đáp ứng nhanh với liệu pháp ức chế miễn dịch. - Mục tiêu protein niệu là cụ thể đối với từng thể bệnh viêm cầu thận |
| Quan điểm thực hành 1.5.5; Theo dõi các xét nghiệm thường xuyên khi điều trị với ACEi hoặc ARB | - Chỉnh liều ACEi hoặc ARB có thể gây tổn thương thận cấp hoặc tăng kali máu. |
| Quan điểm thực hành 1.5.6: Tư vấn bệnh nhân ngừng ACEi hoặc ARB và thuốc lợi tiểu khi có nguy cơ giảm thể tích tuần hoàn | - Nguy cơ cao tổn thương thận cấp và tăng kali máu. - Tư vấn bệnh nhân tuỳ thuộc vào trình độ học vấn và nền văn hóa của họ. - Cân nhắc ngừng thuốc ức chế hệ RAA |
Quan điểm thực hành 1.5.7: Để dùng các thuốc ức chế hệ RAA kiểm soát huyết áp và giảm protein niệu thì nên dùng các thuốc lợi tiểu thải kali và/hoặc các thuốc gắn với kali để hạ kali máu về mức bình thường,. Điều trị toan chuyển hoá (bicarbonate huyết thanh < 22 mmol/l) | - Thuốc lợi tiểu quai - Thuốc lợi tiểu thiazide - Patiromer - Sodium zirconium cyclosilicate (mỗi 10g sodium zirconium cyclosilicate chứa 800mg natri) - Viên uống bổ sung natri bicarbonate |
| Quan điểm thực hành 1.5.8: Áp dụng thay đổi lối sống cho tất cả các bệnh nhân viêm cầu thận nhằm cải thiện kiếm soát huyết áp và protein niệu | - Hạn chế natri trong chế độ ăn <2.0 g/ngày (<90 mmol/ngày) - Đưa cân nặng về bình thường - Tập thể dục thường xuyên - Ngừng hút thuốc |
| Quan điểm thực hành 1.5.9: Tích cực hạn chế natri trong chế độ ăn ở những bệnh | nhân thất bại trong giảm protein niệu, và những người đang dùng liều thuốc tối đa có thể dung nạp | - Hạn chế natri trong chế độ ăn <2.0 g/ngày (<90 mmol/ngày ). Cân nhắc sử dụng thuốc đối kháng thụ thể mineralocorticoid trong một số trường hợp kháng trị (theo dõi tăng kali máu). |
Chú thích: ACEi, thuốc ức chế men chuyển angiotensin; ARB, thuốc chẹn thụ thể angiotensin II; FSGS, xơ hoá cầu thận ổ đoạn; MCD, bệnh cầu thận thể thay đổi tối thiểu; SSNS, hội chứng thận hư nhạy với steroid.
1.1.6 Quản lý tăng lipid máu ở bệnh cầu thận
Bảng 3. Quản lý tăng lipid máu ở bệnh cầu thận
| Quan điểm thực hành 1.6.1: Cân nhắc điều trị tăng lipid máu ở những bệnh nhân hội chứng thận hư, cụ thể là bệnh nhân có các yếu tố nguy cơ tim mạch (bao gồm tăng huyết áp và đái tháo đường) | Không đủ thông tin chất lượng cao để hướng dẫn điều trị ở các bệnh nhân này |
Quan điểm thực hành 1.6.2: Thay đổi lối sống cho tất cả các bệnh nhân tăng lipid máu dai dẳng và có bệnh cầu thận: - Chế độ ăn tốt cho tim mạch - Tăng cường hoạt động thể lực - Giảm cân - Bỏ thuốc lá | - Chưa được nghiên cứu kỹ như là phương pháp chính để hạ lipid trong hội chứng thận hư - Có thể được dùng như là phương pháp chính ở những bệnh nhân có nguy cơ thấp với tăng lipid máu từ nhẹ đến vừa - Phối hợp với phương pháp điều trị hạ lipid máu bằng thuốc - Được xem như là phương pháp đầu tay điều trị tăng lipid máu ở trẻ em - Xem xét chế độ ăn nhiều thực vật - Tránh ăn thịt đỏ |
Quan điểm thực hành 1.6.3: Cân - Đánh giá nguy cơ bệnh tim mạch do vữa xơ (ASCVD) dựa vào mức LDL-C, Apo B, triglyceride và mức Lp (a), nhóm tuổi và các “yếu tố thúc đẩy" ASCVD - Điều chỉnh liều statin dựa vào nguy cơ ASCVD - Statin có thể được khởi trị ở trẻ > 8 tuổi có liên quan tiền sử gia đình, LDL-C hoặc Lp(a) tăng quá cao, trong bối cảnh ra quyết định dựa trên thông tin được chia sẻ và tư vấn với bệnh nhân và gia đình | - Giảm eGFR (<60 ml/phút/1.73m² chưa lọc máu) và albumin niệu (ACR >30 mg/g) liên quan độc lập với tăng nguy cơ tăng ASCVD - Các yếu tố thúc đẩy nguy cơ ASCVD bao gồm tình trạng viêm mạn tính: lupus ban đỏ hệ thống, viêm khớp dạng thấp, tiền sử tiền sản giật, mãn kinh sớm, nguồn gốc Nam Á, bệnh thận mạn và HIV/ AIDS (Độ chính xác của các yếu tố đánh giá nguy cơ ASCVD chưa được xác thực rõ ràng ở bệnh nhân trưởng thành có bệnh mạn tính hoặc HIV). - Xét nghiệm lipid máu đói và các chỉ số an toàn thích hợp (indicators safety appopriate) để đánh giá việc tuân thủ thay đổi lối sống và tác dụng của các thuốc giảm LDL-C, thực hiện sau 4-12 tuần khi khởi trị/chỉnh liều statin hoặc liệu pháp điều chỉnh bệnh lý viêm/liệu pháp kháng retrovirus và mỗi 3-12 tháng sau đó dựa trên nhu cầu đánh giá sự tuân thủ và an toàn |
Quan điểm thực hành 1.6.4: Cân nhắc khởi trị liệu pháp không có statin ở những bệnh nhân không dung nạp statin, hoặc có nguy cơ ASCVD cao và không đạt đích LDL-C / triglyceride dù đã dùng liều tối đa có thể dung nap : - Thuốc cô lập acid mật - Fibrates - Acid Nicotinic - Ezetimibe - Ức chế PCSK9 - Lọc hấp thụ lipid | - Thuốc cô lập acid mật có nhiều tác dụng phụ trên hệ tiêu hoá gây hạn chế sử dụng - Thuốc cô lập acid mật và fibrates được chứng minh các nghiên cứu nhỏ làm giảm cholesterol huyết thanh trong hội chứng thận hư - Fibrates làm tăng creatinine huyết thanh do tác động trực tiếp lên thận - Ezetimibe có ít lợi ích trên mạch máu và lâm sàng, nhưng được sử dụng trên bệnh nhân không dung nạp statin như liệu pháp Cứu văn - Nicotinic acid và ezetimibe chưa được nghiên cứu trên những bệnh nhân hội chứng thận hư - Chất ức chế PCSK9 có thể có lợi ích trong hội chứng thận hư và các thử nghiệm đang được tiến hành |
ACR, tỷ albumin-creatinine; ASCVD, atherosclerotic cardiovascular disease: bệnh tim mạch do vữa xơ; HIV, virus suy giảm miễn dịch ở người; AIDS, hội chứng suy giảm miễn dịch mắc phải; Apo, apolipoprotein; eGFR, mức lọc cầu thận ước tính; LDL-C, lipoprotein cholesterol trọng lượng phân tử thấp; Lp, lipoprotein; PCSK9, proprotein convertase subtilisin/kexin type 9
1.1.7 Tăng đông và huyết khối
Quan điểm thực hành 1.7.1: Chỉ định liệu pháp chống đông đầy đủ cho bệnh nhân có biến cố thuyên tắc huyết khối trên nến hội chứng thận hư. Nên áp dụng chống đông dự phòng cho bệnh nhân hội chứng thận hư khi nguy cơ thuyên tắc huyết khối vượt quá nguy cơ ước tính xảy ra biến cố xuất huyết nghiêm trọng do thuốc chống đông trên từng bệnh nhân cụ thể (Bảng 4).
Bảng 4. Chống đông trong hội chứng thận hư
| Với biến cố thuyên tắc huyết khối, cần dùng chống đông đủ liều trong 6-12 tháng và/hoặc theo thời gian mắc hội chứng thận hư | Cân nhắc dự phòng chống đông đủ liều nếu:* | Chống chỉ định tương đối hoặc tuyệt đối với dự phòng thuốc chống đông |
| Huyết khối tĩnh mạch | Albumin huyết thanh <20-25 g/L và có bất kỳ yếu tố nào sau đây: - Protein niệu >10 g/ngày - Chỉ số khối cơ thể >35 kg/m² - Định vị gen (genetic disposition) gây thuyên tắc huyết khối - Suy tim NYHA III hoặc IV - Có phẫu thuật chỉnh hình hoặc vùng bụng gần đây - Bất động kéo dài | - Sở thích/khả năng tuân thủ của bệnh nhân - Dễ chảy máu - Có thương tổn hệ thần kinh trung ương dễ xuất huyết - Đột biến gen ảnh hưởng chuyến hoá hiệu quả của warfarin - Yếu người (dễ ngã) - Tiền sử xuất huyết tiêu hóa |
| Huyết khối động mạch | ||
| Thuyên tắc phổi | ||
| Rung nhĩ không do van tim |
(*) Viêm cầu thận màng có nguy cơ cao xảy ra các biến cố thuyên tắc huyết khối. NYHA, Hiệp hội Tim mạch New York.
Quan điểm thực hành 1.7.2: Cân nhắc liều chống đông ở bệnh nhân hội chứng thận hư (Bảng 5 và hình 3).
Bảng 5. Xem xét liều chống đông ở bệnh nhân hội chứng thận hư
| Dự phòng chống đông trong các biến cố thoáng qua có nguy cơ cao |
- Chống đông liều thấp (ví dụ: Heparin không phân đoạn 5000 UI tiêm dưới da 2 lần/ngày) - Heparin trọng lượng phân tử thấp: nên giảm liều khi độ thanh thải creatinine <30 ml/phút (không cần hiệu chỉnh theo diện tích bề mặt cơ thể), tránh sử dụng khi suy thận |
| Liệu pháp chống đông warfarin đầy đủ sử dụng cho biến cố thuyên tắc huyết khối |
- Ưu tiên heparin đường tĩnh mạch sau đó bắt cầu với wafarin - Có thể dùng heparin liều cao hơn bình thường trong hội chứng thận hư do mất antithrombin III qua nước tiểu - Lựa chọn điều trị chốn đôn với warfarin lâu dài theo kinh n hiệm cho đến khi các nghiên cứu dược động học được thực hiện trên các chế phẩm mới hơn. - TI lệ warfarin gắn với protein có thể biến động theo sự thay đổi của albumin huyết thanh vì vậy nên theo dôi INR thường xuyên. - Mục tiêu INR là từ 2-3 - Các khuyến cáo này không được ủng hộ bởi các thử nghiệm ngẫu nhiên có đối chứng - Chú ý tương tác giữa warfarin với các thuốc khác |
| Thuốc ức chế yếu tố Xa (Xai): chưa có nghiên cứu hệ thống ở bệnh nhân hội chứng thân hư |
- Liều thường dùng trong dân số nói chung được điều chỉnh theo creatinine huyết thanh, độ thanh thải creatinin (ước tính bởi công thức Cockcroft-Gault), tuổi và cân nặng. Độ thanh thải của thuốc ức chế Xa trong nước tiểu khác nhau: +Apixaban, 27% +Edoxaban, 50% +Rivaroxaban, 66% - Tác dụng giảm albumin máu khi dùng thuốc còn chưa được nghiên cứu, và những thuốc này gắn với albumin rất nhiều làm ảnh hưởng đáng kể đến thời gian bán thải của thuốc - Mức độ gần protein: +Apixaban, 92-94% +Edoxaban, 55% +Rivaroxaban, 92-95 % - Mặc dù có một số ít trường hợp báo cáo là có lợi, các đặc tính dược động học của những thuốc này cần được nghiên cứu thêm về cả độ an toàn và hiệu quả trước khi chúng được khuyến cáo rộng rãi ở bệnh nhân hội chứng thận hư |
| Ức chế trực tiếp thrombin (DTI): chưa có nghiên cứu hệ thống ở bệnh nhân hội chứng thận hư |
- Liều thường dùng dabigatran trong dân số nói chung được điều chỉnh theo độ thanh thải creatinin, argatroban không cần chỉnh liều. Độ thanh thải của DTI trong nước tiểu khác nhau: +Argatroban, 22% (6% ở dạng chuyển hóa, 16% ở dạng không chuyển hóa) +Dabigatran etexilate, 7% - Tác dụng giảm albumin máu khi dùng thuốc chưa được nghiên cứu, và những thuốc này ít gắn với albumin nên ít ảnh hưởng đến thời gian bán thải của thuốc - Mức độ gần protein: +Argatroban, 54 % +Dabigatran etexilate, 35% - Mặc dù được chứng minh an toàn với dân số nói chung, các đặc tính dược động học của những thuốc này cần được nghiên cứu thêm về cả độ an toàn và hiệu quả trước khi được khuyến cáo ở bệnh nhân hôi chứng thận hư |

Chú ý: Lưu đồ này dành cho bệnh nhân bệnh cầu thận màng. Với bệnh nhân hội chứng thận hư, các giá trị chưa rõ do các tình trạng bệnh lý kèm theo. Ở trẻ mắc viêm cầu thận, cân nhắc hội chẩn chuyên khoa huyết học để đánh giá nguy cơ thuyên tắc huyết khối tĩnh mạch (VTE) và nguy cơ xuất huyết. Điểm nguy cơ Framingham không dùng cho trẻ em.
(≠) Giá trị albumin là 25g/L hoặc 32g/L (2.5g/dl hoặc 3.2g/dl) khi đo bằng bromocresol xanh (BCG). Giá trị albumin là 20g/L hoặc 30g/L (2g/dL hoặc 3g/dL) nên được sử dụng khi đo bằng bromocresol tím (BCP) hoặc các xét nghiệm miễn dịch.
(*) Truy cập công cụ: https://www.med.unc.edu/gntools/bleedrisk.html.
1.1.8 Nguy cơ nhiễm trùng
Quan điểm thực hành 1.8.1: Tiêm chủng vacxin phòng phế cầu ở bệnh nhân bệnh cầu thận và hội chứng thận hư, cũng như các bệnh nhân bệnh thận mạn. Bệnh nhân và người thân nên tiêm chủng vacxin phòng cúm. Bệnh nhân nên được tiêm chủng phòng herpes zoster (Shingrix).
Quan điểm thực hành 1.8.2: Sàng lọc lao (TB), virus viêm gan B (HBV), virus viêm gan C (HCV), virus gây suy giảm miễn dịch ở người (HIV), và giang mai ở những bệnh nhân có bối cảnh lâm sàng phù hợp (xem Chương 7).
Quan điểm thực hành 1.8.3: Ở những bệnh nhân điều trị ức chế miễn dịch mà từng sống ở môi trường nhiệt đới có yếu tố dịch tẻ, những bệnh nhân có tăng bạch cầu ái toan và Immunoglobulin E (IgE) thì nên xem xét có bội nhiễm giun lươn.
Quan điểm thực hành 1.8.4: Nên cân nhắc dự phòng bằng thuốc trimethoprim- Sulfamethoxazole (TMP-SMX) ở bệnh nhân điều trị liều cao prednisone hoặc các chế phẩm ức chế miễn dịch khác (rituximab, cyclophosphamide).
1.1.9 Tính toán kết cục
Quan điểm thực hành 1.9.1: Mục tiêu điều trị trong việc giảm protein niệu là khác nhau giữa các nguyên nhân cụ thể của bệnh cầu thận.
Quan điểm thực hành 1.9.2: Giảm ≥40% eGFR so với mức nền trong khoảng 2-3 năm được xem như thước đo dự báo kết cục suy thận.
1.1.10 Ảnh hưởng của tuổi, giới, chủng tộc, và yếu tố di truyền
[Không có khuyến cáo hay quan điểm thực hành]
1.1.11 Liên quan đến di truyền, phiên mã, protein, chuyển hoá
[Không có khuyến cáo hay quan điểm thực hành]
1.1.12 Sử dụng glucocorticoid và liệu pháp ức chế miễn dịch
[Tham khảo chương riêng để biết thêm thông tin]
1.1.13 Dược lí học các thuốc ức chế miễn dịch
Bảng 6. Giảm thiếu các tác dụng phụ liên quan đến thuốc ức chế miễn dịch
| Quan điểm thực hành 1.13.1: Chọn một phác đồ điều trị viêm cầu thận giúp ngăn chặn tức thời của diễn tiến bệnh chính | - Dựa trên mức độ nghiêm trọng của các triệu chứng hiện có và thể viêm cầu thận để xác định cường độ của liệu pháp tấn công. - Mức lọc cầu thận cần được tính để xác định được liều an toàn. |
| Quan điểm thực hành 1.13.2: Chọn phác đó điều trị viêm cầu thận để ngăn ngừa tiến triển của bệnh | - Không phải tất cả các thế viêm cầu - Có thể cần phải dùng thuốc ức chế miễn dịch kéo dài hoặc phối hợp nhiều đợt thuốc ức chế miễn dịch để ngăn ngừa hoặc làm chậm sự tiến triển bệnh thận mạn hoặc sự tiến triển của tình trạng suy thận - Giảm protein niệu là đích thay thế trong điều trị viêm cầu thận |
| Quan điểm thực hành 1.13.3: Chọn phác đó điều trị viêm cầu thận nhằm giảm thiểu tác dụng phụ nguy hiểm của thuốc ức chế miễn dịch | - Thông báo cho bệnh nhân biết tác dụng phụ của từng thuốc (cả ngắn và dài hạn) - Xem xét quan điểm của bệnh nhân trong việc ra quyết định chung - Thích hợp khi tầm soát những bệnh nhiễm trùng tiềm tàng trước khi khởi trị liệu pháp ức chế miễn dịch. - Theo dõi nồng độ thuốc điều trị (khi có chỉ định trên lâm sàng) - Kê đơn thuốc dự phòng các tác dụng phụ cụ thể của thuốc ức chế miễn dịch - Xem xét tình trạng tiêm chủng và cập nhật khi cần - Bảo tồn khả năng sinh sản cho bệnh nhân (nếu được chỉ định) - Theo dõi tiến triển của các bệnh ung thư hoặc nhiễm trùng - Sử dụng kéo dài thuốc ức chế miễn dịch hoặc phối hợp nhiều thuốc dùng thuốc ức chế miễn dịch đi kèm đến việc phơi nhiễm các hoá chất độc hại theo thời gian |
1.1.14 Quản lý chế độ ăn ở bệnh cầu thận
Bảng 7. Gợi ý về chế độ ăn ở bệnh cầu thận
| Quan điểm thực hành 1.14.1: Hạn chế natri trong chế độ ăn làm giảm phù, kiểm soát huyết áp, và kiểm soát protein niệu | - Natri trong chế độ ăn <2.0 g/ngày (<90 mmol/ngày) |
| Quan điểm thực hành 1.14.2: Hạn chế protein trong chế độ ăn dựa trên mức độ protein niệu | - Protein niệu ngưỡng hội chứng thận hư: bổ sung lượng protein 0.8- 1g/kg/ngày (cân nặng lý tưởng) - Bổ sung 1g trên mỗi gam protein mất đi (lên đến 5g/ngày) - Mức an toàn của việc hạn chế protein ở bệnh nhân viêm cầu thận chưa được chứng minh trên trẻ em. - Có thể khuyến khích chế độ ăn nhiều thực vật. |
| Quan điểm thực hành 1.14.3: Hạn chế protein trong chế độ ăn dựa trên chức năng thận | - Mức lọc cầu thận ước tính <60 ml/phút/1.73m² ở bệnh nhân protein niệu ngưỡng hội chứng thận hư - Giới hạn hoặc đích bổ sung lên đến 0.8g/kg/ngày - Tránh bổ sung <0.6 g/kg/ngày để đảm bảo không thiếu dinh dưỡng - Nhấn mạnh các nguồn protein từ rau quả (thực vật) là thích hợp |
| Quan điểm thực hành 1.14.4: Hạn chế lượng calo nạp vào để đạt chỉ số khối cơ thể (BMI) bình thường và hạn chế béo trung tâm nhằm giảm sự tiến triển của bệnh thận mạn, diễn biến của suy thận, các biến cố tim mạch và tử vong | - Mục tiêu năng lượng nạp vào 35 kcal/kg/ngày - Mức lọc cầu thận ước tinh <60 ml/phút/1.73m²: 30-35 kcal/kg/ngày |
| Quan điểm thực hình 1.14.5: Hạn chế chất béo trong chế độ ăn ở những bệnh nhân có tăng cholesterol huyết thanh nhằm ngăn ngừa các biến chứng tim mạch | - Chế độ ăn tốt cho tim mạch - Chất béo trong chế độ ăn <30% tổng năng lượng - Chất béo đơn và đa không bão hoà chiếm 7%-10% tổng năng lượng |
1.2 CHƯƠNG 3: BỆNH CẦU THẬN MÀNG
1.2.1 Chẩn đoán
Quan điểm thực hành 3.1.1: Không cần thiết sinh thiết thận để xác định chẩn đoán bệnh cầu thận màng (MN) ở bệnh nhân có hội chứng thận hư và có kháng thể kháng PLA2R dương tính.
Quan điểm thực hành 3.1.2: Nên đánh giá các bệnh đi kèm ở những bệnh nhân có bệnh cầu thận màng, dù có hay không các kháng thể kháng PLA2R và/hoặc các kháng thể kháng THSD7A.
Đánh giá các bệnh đi kèm của bệnh nhân bệnh cầu thận màng
• Sàng lọc các bệnh lý ác tính(*) (dân số và độ tuổi phù hợp)
• Siêu âm thận
• Viêm gan virus B; Viêm gan virus C; bệnh giang mai (khi có chỉ định)
• X-Quang ngực (sarcoidosis) • Tiền sử dùng thuốc (NSAIDs, muối vàng, penicillamine)
• Kháng thể kháng nhân
• Tiền sử (bệnh lý hệ thống, bệnh tuyến giáp,..) và thăm khám (da, khớp)
Bệnh nhân bệnh cầu thận màng nên được đánh giá các bệnh đi kèm, không phụ thuộc vào có hay không của các kháng thể kháng PLA2R hoặc THD7A.
(*) Khác nhau ở mỗi quốc gia, hiệu suất sàng lọc ung thư không cao, đặc biệt ở những bệnh nhân trẻ. Nhiều trung tâm tiến hành làm X-quang và chụp cắt lớp vi tính lồng ngực, tìm kiếm sự thiếu hụt Fe, và yêu cầu bệnh nhân tham gia chương trình sàng lọc ung thư vú và ung thư đại tràng của quốc gia, làm xét nghiệm kháng nguyên đặc hiệu tuyến tiền liệt (PSA) ở nam giới có độ tuổi > 50-60 tuổi.
1.2.2 Tiên lượng
Quan điểm thực hành 3.2.1: Ở những bệnh nhân bệnh cầu thận màng, sử dụng tiêu chuẩn lâm sàng và cận lâm sàng để đánh giá nguy cơ mất chức năng thận tiến triển (bảng 8).
Bảng 8. Tiêu chuẩn lâm sàng để đánh giá nguy cơ mất chức năng thận tiến triển.
| Nguy cơ thấp | Nguy cơ trung bình | Nguy cơ cao | Nguy cơ rất cao |
• eGFR bình thường, protein niệu < 3.5g/ngày| và albumin huyết thanh > 30g/l HOẶC • eGFR bình thường, protein niệu < 3.5g/ngày hoặc giảm > 50% sau 6 tháng điều trị bảo tồn với ACEI/ARB | • eGFR bình thường, protein niệu > 3.5g/ngày hoặc không giảm > 50% sau 6 tháng điều trị bảo tồn với ACEi/ARB • Không đủ tiêu chuẩn nguy cơ cao | • eGFR <60ml/phút/1.73m² (*) và/hoặc protein niệu > 8g/ngày trên 6 tháng HOẶC • eGFR thường, bình protein niệu > 3.5g/ngày hoặc không giảm> 50% sau 6 tháng điều trị bảo tồn với ACEI/ARB VÀ ít nhất một trong điều kiện sau: • Albumin huyết thanh < 25g/l (+) • PLA2Rab > 50RU/ml (≠) • α1- microglobulin trong nước tiểu > 40ug/min • β2- microglobulin > 250mg/ngày • Chỉ số chọn lọc > 0.20 (γ) | • Hội chứng thận hư nguy hiểm tính mạng HOẶC • Suy giảm chức năng thận nhanh chóng không thể giải thích bằng nguyên nhân khác |
eGFR và PCR được sử dụng trong theo dõi lâm sàng thường quy. Dấu ấn sinh học khác có thể không có sẵn ở tất cả các bệnh viện, bảng trên cung cấp một cái nhìn khái quát của các dấu ấn sinh học hữu ích.
(*) Hầu hết các nghiên cứu đã sử dụng giá trị creatinine huyết thanh để hướng dẫn điều trị, và giá trị SCr > 1.5mg/dL (133µmol/L) thường được sử dụng để xác định tình trạng giảm chức năng thận. Giá trị eGFR 60mL/phút/1.73m² phản ánh tình trạng suy chức năng thận ở bênh nhân trẻ. Điều quan trọng cần chú ý là eGFR giảm theo độ tuổi, ví dụ giá trị SCr 1.5mg/dL (133µmol/L) phản ánh eGFR là 50 mL/phút/1.73m² ở bệnh nhân nam 60 tuổi và phản ánh 37 mL/phút/1.73m² ở bệnh nhân nữ 60 tuổi. Do vậy, khi cân nhắc sử dụng eGFR để ước tính nguy cơ thì cần chú ý đến độ tuổi.
(+) Nên định lượng albumin huyết thanh bằng BCP hay phương pháp định lượng miễn dịch.
(≠) Chưa được công nhận những giá trị điểm cất (cutoff). Nên định lượng kháng thể kháng PLA2R mỗi 3-6 tháng, với bệnh nhân có nồng độ kháng thể kháng PLA2R ban đầu cao thì nên làm trong khoảng thời gian ngắn hơn. Sự thay đổi của nồng độ kháng thể kháng PLA2R trong quá trình theo dõi có thể thêm vào ước tính nguy cơ. Việc biến mất của kháng thể kháng PLA2R xảy ra trước khi có sự thuyên giảm về lâm sàng và nên dẫn đến ngừng liệu pháp bổ sung. Dữ liệu chi tiết còn hạn chế.
(γ) Chỉ số chọn lọc (selectivity index) được tính toán như độ thanh thải của IgG/độ thanh thải của albumin.
BCP, tím bromcresol; eGFR, mức lọc cầu thận ước tính; ab-PLA2R, kháng thể kháng PLA2R.
1.2.3 Điều trị
Quan điểm thực hành 3.3.1: Cân nhắc điều trị cho bệnh nhân bệnh cầu thận màng nguyên phát:
• Tất cả bệnh nhân bệnh cầu thận màng nguyên phát kèm protein niệu nên nhận điều trị hỗ trợ tối ưu.
• Nên hạn chế liệu pháp ức chế miễn dịch cho những bệnh nhân được xem là có nguy cơ tổn thương thận tiến triển (hình 4).

(*) Xem thêm quan điểm thực hành 3.2.1 và bảng 8 để được mô tả chi tiết việc đánh giá nguy cơ.
(+) Chất ức chế Calcineurin (CNI) đơn trị ít hiệu quả. Điều trị bằng CNI trong 6-12 tháng và ngừng thuốc đột ngột thường kèm theo tỉ lệ tái phát cao. Tuy nhiên, việc sử dụng CNI có thể cân nhắc ở bệnh nhân có eGFR bình thường và nguy cơ tiến triển trung bình, vì nhiều trường hợp bệnh sẽ có tự thuyên giảm. Việc sử dụng CNI sẽ rút ngắn thời gian tồn tại protein niệu. Ở những bệnh nhân có nguy cơ tiên triển cao, nên thêm rituximab sau 6 tháng điều trị với CNI, có thể không dùng rituximab ở bệnh nhân có ghi nhận không còn kháng thể kháng PLA2R sau điều trị CNI.
(≠) Không có đầy đủ bằng chứng cho việc sử dụng liều tiêu chuẩn để ngăn ngừa khởi phát suy thận. Nên giảm nửa liều cyclophosphamide neu eGFR giảm dưới 50mL/phút/1.73m². Rituximab có thể chỉ định ở bệnh nhân không dung nạp hay không còn dùng cysclophosphamide. Nên hội chẩn cùng các chuyên gia.
Quan điểm thực hành 3.3.2: Không cần dùng liệu pháp ức chế miễn dịch ở những bệnh nhân có bệnh cầu thận màng, protein niệu < 3.5g/ngày, albumin huyết thanh > 30g/L đo bằng tím bromcresol hoặc phương pháp định lượng miễn dịch, và eGFR > 60ml/phút/1.73m².
Quan điểm thực hành 3.3.3: Liệu pháp ức chế miễn dịch không cần dùng ở những bệnh nhân có bệnh cầu thận màng, hội chứng thận hư, và eGFR bình thường; trừ khi có ít nhất một nguy cơ tiến triển bệnh hoặc có biến chứng của hội chứng thận hư nghiêm trọng (ví dụ: tổn thương thận cấp, biến cố thuyên tắc khuyết khối) đã xảy ra.
Khuyến cáo 3.3.1: Đối với bệnh nhân có bệnh cầu thận màng và ít nhất một yếu tố nguy cơ tiến triển bệnh, khuyến cáo nên sử dụng rituximab hoặc cyclophosphamide và glucorticoid luân phiên hàng tháng trong 6 tháng, hoặc liệu pháp dựa trên CNI ≥ 6 tháng, (và lựa chọn điều trị phụ thuộc vào ước tính nguy cơ xem Bảng 8 và Hình 4) (1B).
Quan điểm thực hành 3.3.4: Sau khi khởi trị, theo dõi nồng độ kháng thể kháng PLA2R sau 6 tháng có thể hữu ích để đánh giá đáp ứng điều trị của bệnh nhân mắc bệnh cầu thận màng, và có thể được sử dụng để hướng dẫn điều chỉnh điều trị (Hình 5)

Chú ý: Liều tích lũy của cysclophosphamide không nên quá 36g trong bối cảnh có nguy cơ các bệnh lý ác tính (chương 1). Để an toàn, thường giới hạn liều tích lũy đến 25g (nam giới 80kg: cysclophosphamide luân phiên trong 6 tháng với liều 2.5mg/kg/ngày tương đương với 18g, và cysclophosphamide hàng ngày 6 tháng với liều 1.5mg/kg/ngày tương đương với 22g). Ở bệnh nhân có mong muốn mang thai nên dùng liều thấp hơn (tối đa 10g). CNI dường như không dẫn đến thuyên giảm về miễn dịch muộn; ở bệnh nhân có kháng thể kháng PLA2R tồn tại kéo dài, CNI có thể kết hợp với rituximab. Giảm số lượng tế bào B là không đủ để đánh giá hiệu quả điều trị của rituximab; có thể cân nhắc bổ sung liều ngay cả khi nếu tế bào B trong máu ngoại vi giảm thấp. Tuy nhiên, ở những bệnh nhân này nên hội chẩn cùng với các chuyên gia. eGFR nên ổn định, nếu không ổn định thì luôn tìm các nguyên nhân khác hoặc nếu eGFR giảm là do bệnh cầu thận màng hoạt động, luôn luôn cung cấp điều trị bổ sung.
(*) Một vài cơ sở y tế sẽ định lượng kháng thể kháng PLA2R vào tháng thứ 3, và điều chỉnh điều trị trong thời gian đó. Ở hầu hết bệnh nhân, đáp ứng xảy ra trong 3 tháng sau khởi trị.
(+) Phản ứng miễn dịch huỳnh quang âm tính biểu thị có thuyên giảm về phương diện miễn dịch. Nếu định lượng bởi phương pháp ELISA, giá trị cutoff 2 RU/mL nên được dùng để xác định thuyên giảm miễn dịch hoàn toàn.
(≠) Nên tái điều trị với rituximab tương tự như điều trị ban đầu với 1 hoặc 2 lần truyền rituximab 1g, mỗi lần cách nhau 2 tuần.
PLA2Rab: kháng thể kháng PLA2R
1.2.4 Những tình huống đặc biệt
Quan điểm thực hành 3.4.1: Lưu đồ điều trị bệnh nhân bệnh cầu thận màng tái phát lần đầu sau điều trị (Hình 6).

Chi tiết về những phác đồ điều trị thường được sử dụng được trình bày trong bảng 9
(*) Định nghĩa tái phát có thể thay đổi. Một số tác giả định nghĩa tái phát sau thuyên giảm khi có tăng protein niệu > 3.5 g/ngày ở bệnh nhân đã thuyên giảm một phần hoặc hoàn toàn. Nên sử dụng albumin huyết thanh và PCR trong đánh giá. Nếu PCR giảm đến giá trị trong khoảng 2-3,5 g/ngày và albumin huyết thanh chưa đạt mức bình thường, thì sự tăng PCR sau đó nên được xem là bệnh kháng thuốc hơn là tái phát sau thuyên giảm. Ở những bệnh nhân thuyên giảm một phần (đặc trưng bởi albumin huyết thanh bình thường), thì định nghĩa tái phát được xác định khi tăng protein niệu song song giảm nồng độ albumin huyết thanh.
(+) Theo dõi xét nghiệm về miễn dịch đặc biệt có giá trị rất lớn trong những tình huống này. Nếu trong thời kì “thuyên giảm về mặt lâm sàng" mà kháng thể kháng PLA2R vẫn dương tính, thì đây là bằng chứng cho thấy bệnh kháng thuốc. Do đó, những bệnh nhân có kháng thế kháng PLA2R dương tính, khuyến cáo nên đánh giá kháng thể kháng PLA2R trong thời kỳ thuyên giảm và tái phát. Sự thay đổi về kháng thể kháng PLA2R nên xảy trước khi có những biến đổi về lâm sàng. Ở những bệnh nhân tái phát sớm, cần xem xét nguyên nhân thất bại điều trị trước đó (ví dụ: tuân thủ, liều thuốc thấp, thiếu số lượng tế bào B, có mặt kháng thể kháng rituximab).
(≠) Có thể lặp lại với Cysclophosphamide, tuy nhiên, cần chú ý đến liều tối đa có thể dung nạp: liều tích luỹ không nên quá 10g nếu bệnh nhân muốn duy trì khả năng sinh sản, và liều tích luỹ không nên quá 36g để hạn chế nguy cơ bệnh lý ác tính.
PCR: ti protein niệu/creatinin niệu; PLA2R: thụ thể phospholipase A2 tuýp M.
Bảng 9. Các phác đồ điều trị thường sử dụng ở bệnh nhân bệnh cầu thận màng
| Cyclophosphamide (Chu kỳ) | • Methylprednisolone 1g tiêm tĩnh mạch x 3 ngày liên tiếp vào đầu tháng thứ 1, 3 và 5 • Prednisone 0,5 mg/kg/ngày vào tháng thứ 1, 3, 5 • Cyclophosphamide 2,5 mg/kg/ngày vào tháng thứ 2, 4, 6 |
| Cyclophosphamide (Liên tục) | • Methylprednisolone 1g tiêm tĩnh mạch x 3 ngày liên tiếp vào đầu tháng thứ 1, 3 và 5 • Prednisone 0,5 mg/kg/ngày cách ngày trong tháng thứ 1 ->6, giảm dần liều sau đó • Cyclophosphamide 1,5 mg/kg/ngày vào tháng thứ 1 -> 6 |
| Rituximab | • Rituximab 1g tiêm tĩnh mạch x 2 lần cách nhau mỗi 2 tuần(*) • Rituximab 375 mg/m² da x 1-4 lần cách nhau mỗi 1 tuần |
| Tacrolimus | Tacrolimus 0,05-0,1 mg/kg/ngày, mục tiêu nồng độ thấp nhất 3-8 ng/ml (3,7-9,9 mmol/l), thời gian 12 tháng (t) |
| Cyclosporine | Cyclosporine 3,5 mg/kg/ngày, mục tiêu nồng độ thấp nhất 125-225 ng/ml (104-187 mmol/l) (+) |
(*) Xem xét lặp lại sau 6 tháng ở những bệnh nhân có hội chứng thận hư kéo dài, eGFR ổn định, đặc biệt nếu kháng thể kháng PLA2R vẫn dương tính
(+) Thường kết hợp Cyclosporine hoặc tacrolimus với prednisone với liều 10 mg/ngày. Sau 4 tháng, ngưng sử dụng nếu không đáp ứng; sau 12 tháng, xem xét giảm dần liều.
Quan điểm thực hành 3.4.2: Đánh giá bệnh nhân bệnh cầu thận màng kháng thuốc (Hình 7)

Chi tiết các phác đồ điều trị thường sử dụng được trình bày bảng 9
(*) Đánh giá: Đối với những bệnh nhân kháng thuốc, nên kiểm tra sự tuân thủ điều trị và theo dõi hiệu quả (ví dụ: đáp ứng về tế bào B, kháng thể kháng rituximab, nồng độ IgG, giảm bạch cầu khi dùng cyclophosphamide, nồng độ CNI). Protein niệu kéo dài là không đủ để xác định có để kháng điều trị. Nếu protein niệu vẫn còn trong khi albumin huyết thanh tăng thì nên nghĩ đến bệnh xơ hóa cầu thận ố đoạn (FSGS) và nếu các kháng thể kháng PLA2R biến mất thì sẽ hỗ trợ thêm chẩn đoán. Đối với bệnh nhân có protein niệu kéo dài với nồng độ albumin huyết thanh bình thường hoặc gần như bình thường hoặc những bệnh nhân có protein niệu kéo dài dù có biến mất kháng thể kháng PLA2R, thì nên cân nhắc sinh thiết thận để làm bằng chứng cho bệnh cầu thận màng hoạt động.
(†) Khi có chỉ định, điều trị với thuốc hàng hai phụ thuộc vào mức độ giảm eGFR. Khi chọn rituximab làm phương pháp điều trị hàng hai, nên đánh giá sự đáp ứng của protein niệu và kháng thể kháng PLA2R sau 3 tháng. Điều trị bằng Cyclophosphamide nên thực hiện tính đến liều tối đa có thể dung nạp được: Liều tích lũy không được vượt quá 10 g khi muốn bảo tồn khả năng sinh sản. Liều tích lũy không được vượt quá 36 g để hạn chế rủi ro bệnh ác tính. Các trung tâm chuyên sâu vẫn có thể sử dụng nhiều hơn, dựa trên việc cân nhắc giữa rủi ro và lợi ích.
(≠) Nên chuyển những bệnh nhân không đáp ứng với rituximab hoặc cyclophosphamide tới trung tâm chuyên sâu. Các trung tâm này có thể chọn liệu pháp thử nghiệm (bortezomib, liệu pháp kháng CD38 và belimumab) hoặc liều cao hơn của liệu pháp ức chế miễn dịch thông thường.
Quan điểm thực hành 3.4.3: Đánh giá bệnh nhân ghép thận có bệnh cầu thận màng (Hình 8)

| Thảo luận về tỉ lệ tái phát |
| Nguy cơ tái phát phụ thuộc vào việc đánh giá kháng thể nguyên nhân (causative antibodies) |
| Nguy cơ tái phát có thể cao hơn sau khi ghép thận từ người sống cho thận, nhưng đạt nhiều lợi ích hơn là tác hại của việc bệnh tái phát. |
| Theo dõi trước và sau ghép thận |
| Định lượng protein niệu hàng tháng nếu protein niệu 1g/ngày → sinh thiết thận |
• Bệnh nhân có bệnh cầu thận màng liên quan kháng thể kháng PLA2R: định lượng kháng thể kháng PLA2R mỗi 1-3 tháng phụ thuộc vào tình trạng kháng thể trước ghép thận → Kháng thể kháng PLA2R tăng thận sớm → Kháng thể kháng PLA2R giảm khả năng tái phát tăng, cân nhắc sinh thiết khả năng tái phát thấp hơn, tiến hành sinh thiết thận nếu có chỉ định trên lâm sang |
| Điều trị tái phát |
| Điều trị bằng ACEi/ARB |
| Đảm bảo tuân thủ phác đồ ức chế miễn dịch sau ghép, bao gồm theo dõi nồng độ thuốc |
| Protein niệu < 1g/ngày -> đánh giá/ theo dõi mỗi 1-3 tháng |
| Protein niệu > 1g/ngày→ rituximab 1g ngày 1 và ngày 15 |
(*) Dữ liệu có sẵn hạn chế, nhưng sơ đồ tương tự như áp dụng với bệnh cầu thận màng liên quan kháng THSD7A.
(+) Tái phát về mặt lâm sàng.
(≠) Đây là tỉ lệ tái phát trung bình đã ước tính ở bệnh nhân có bệnh cầu thận màng và kháng nguyên không xác định. Có thể ước tính tốt hơn tỉ lệ tái phát của những bệnh nhân này bằng đánh giá bệnh nhân qua kháng thể/kháng nguyên THSD7A.
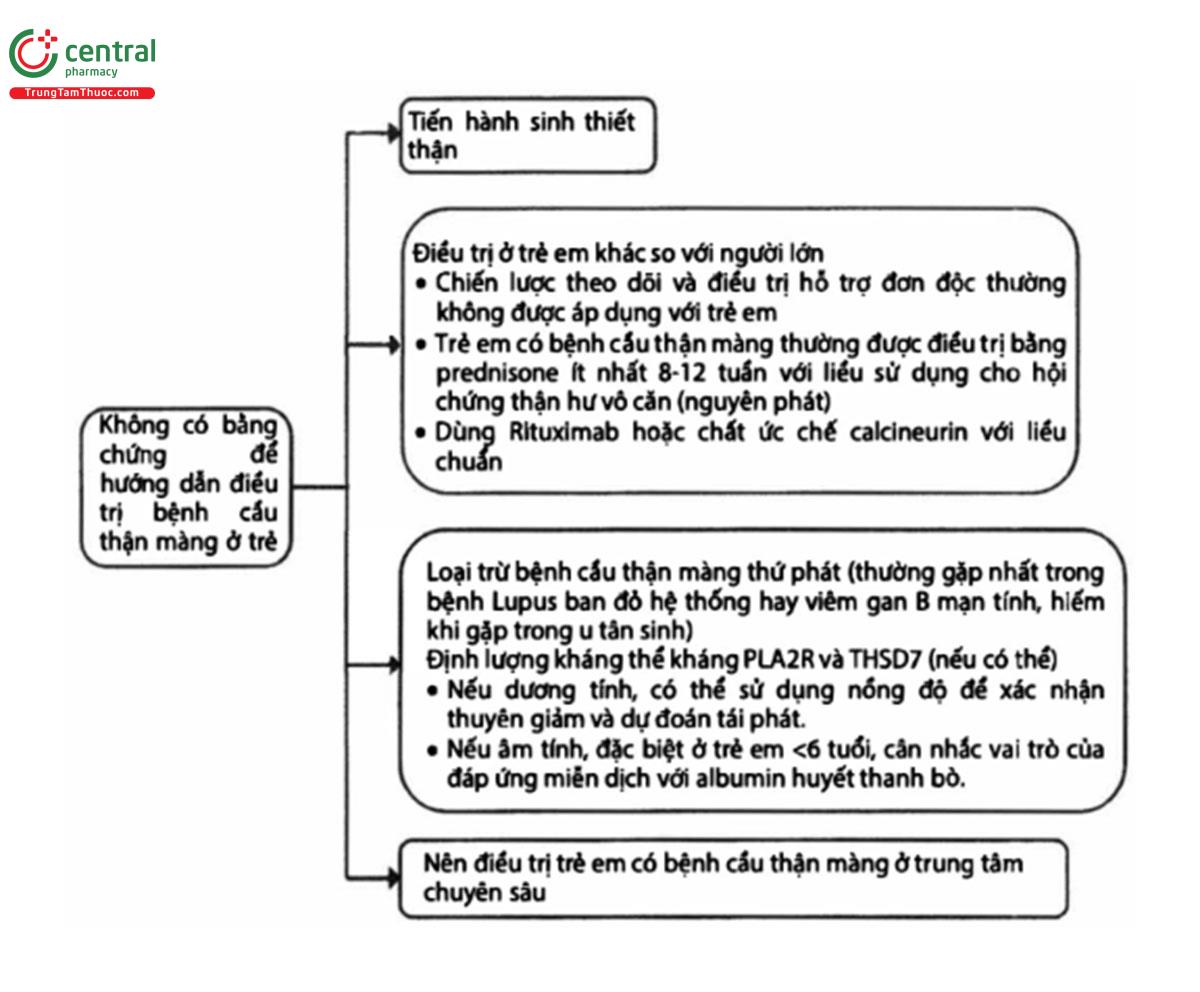
Quan điểm thực hành 3.4.4: Sơ đồ điều trị bệnh cầu thận màng ở trẻ em (Hình 9).
Quan điểm thực hành 3.4.5; Liệu pháp chống đông dự phòng ở bệnh nhân có bệnh thận màng và hội chứng thận hư nên dựa trên ước tính nguy cơ biến có huyết khối và nguy cơ biến chứng xuất huyết (Hình 10).

Có nên sử dụng Aspirin để dự phòng nguyên phát biến cố huyết khối ở bệnh nhân có bệnh cầu thận màng? Sơ đồ trên để xuất liệu pháp chống đông cho bệnh nhân có bệnh cầu thận màng cho bác sĩ lâm sàng. Các giá trị điểm cắt (cutoff) được để xuất được dựa trên ý kiến chuyên gia. Khi cân nhắc liệu pháp chống đông, cần phải cân bằng giữa lợi ích và nguy cơ. Dưới đây là những cân nhắc:
1. Nguy cơ biến cố huyết khối có liên quan đến nồng độ albumin huyết thanh. Cần chủ ý khi có sự khác biệt lớn giữa các xét nghiệm albumin huyết thanh. Nồng độ albumin huyết thanh 25 g/L (2,5 g/dL) với xanh bromcresol (BCG) tương đương với nồng độ 20 g/L (2.0 g/dL) với tím bromocresol (BCP), hoặc xét nghiệm đo độ đục miễn dịch (immunonephelometry). Hầu hết các nghiên cứu sử dụng xét nghiệm BCG. Cân nhắc dùng ngưỡng 25 g/L (2,5 g/dL) khi sử dụng BCG, và 20 g/L (2.0 g/dL) khi sử dụng BCP hoặc xét nghiệm đo độ đục miễn dịch.
2. Đánh giá nguy cơ huyết khối tĩnh mạch và nguy cơ xuất huyết
(hitps://www.med.unc.edu/gntools/bleedrisk.html).
3. Bệnh nhân bệnh cầu thận màng và hội chứng thận hư cũng có nguy cơ biến cố huyết khối động mạch (ATE). Nguy cơ thuyên tắc huyết khối động mạch phụ thuộc vào độ tuổi, tiền sử biến cố trước đây, đái tháo đường, mức lọc cầu thận ước tính (eGFR), hút thuốc lá, và mức độ nghiêm trọng của hội chứng thận hư. Có thể sử dụng điểm nguy cơ Framingham để đánh giá nguy cơ, và bao gồm biến cố trước đây và protein niệu.
4. Sử dụng aspirin là không đủ để phòng ngừa biến cố thuyên tắc huyết khối tĩnh mạch (VTE); sử dụng wafarin là đủ để phòng ngừa ATE.
5. Điều trị với wafarin: Trong hội chứng thận hư có nhiều biến thiên của INR và mức eGFR thấp. Do có nguy cơ cao huyết khối ngay lập tức sau khi khởi trị wafarin liều cao, vì vậy nên cân nhắc khởi trị liệu pháp chống đông với heparin trọng lượng phân tử thấp liều thấp và sau đó bắc cầu với wafarin, khi wafarin có tác dụng điều trị thì ngừng heparin. Một lựa chọn thay thế tốt khác là sử dụng heparin trọng lượng phân tử thấp liều thấp + aspirin trong 3 tháng trước khi chuyển sang wafarin, cho phép đánh giá sự thay đổi protein niệu.
6. Liệu pháp chống đông không nên bỏ qua ở bệnh nhân bắt đầu điều trị với prednisone. vì glucocorticoid tăng nguy cơ huyết khối.
7. Ước tính nguy cơ ATE bằng điểm nguy cơ Framingham, và nguy cơ tăng lên trong trường hợp eGFR thấp hoặc protein niệu cao hơn. Điểm nguy cơ Framingham tính dựa vào tuổi, hút thuốc lá, cholesterol huyết thanh, và huyết áp.
1.3 CHƯƠNG 5: BỆNH CẦU THẬN THỂ THAY ĐỔI TỐI THIẾU (MCD) Ở NGƯỜI LỚN
1.3.1 Chẩn đoán
Quan điểm thực hành 5.1.1: MCD ở người lớn chỉ có thể được chẩn đoán bằng sinh thiết thận.
1.3.2 Tiên lượng
Quan điểm thực hành 5.2.1: Ở những bệnh nhân MCD mà đáp ứng với liệu pháp glucocorticoids có tiên lượng tốt về chức năng thận hơn so với bệnh nhân không đáp ứng.
1.3.3 Điều trị
Khuyến cáo 5.3.1: Khuyến cáo khởi trị glucocorticoid đường uống liều cao cho MCD (1C)
Quan điểm thực hành 5.3.1: Sơ đồ khởi trị cho MCD ở người lớn tưởng thành (Hình 11)

Phác đồ glucocorticoid tối ưu chưa được xác định rõ, liều điều trị theo khuyến cáo xem bảng 9. Khi lựa chọn thuốc nên dựa trên bác sĩ điều trị và mong muốn của bệnh nhân.
Quan điểm thực hành 5.3.2: Glucocorticoid liều cao cho MCD không nên kéo dài quá 16 tuần.
Quan điểm thực hành 5.3.3: Bắt đầu xuống thang glucocorticoid 2 tuần sau khi thuyên giảm hoàn toàn.
Quan điểm thực hành 5.3.4: Có thể cá nhân hóa đường dùng và tần suất sử dụng glucocorticoids theo nhu cầu của bệnh nhân (dù glucocorticoids đường uống hàng ngày thường được sử dụng nhất để điều trị MCD)
Quan điểm thực hành 5.3.5: Cân nhắc khởi trị với cyclophosphamide, chất ức chế calcineurin (CNI), hay Mycophenolate mofetil (MMF) ở những bệnh nhân có chống chỉ định tương đối với glucocorticoids.
Bảng 10. Điều trị MCD ở người trưởng thành: Khởi trị thời điểm ban đầu và MCD tái phát thường xuyên (FR)/ phụ thuộc steroid (SD).
| Thuốc | Phác đồ | Tỷ lệ thuyên giảm (hoàn toàn hoặc một phần) |
Khởi trị, điều trị glucocorticoid Prednisone hoặc prednisolone | Liều: 1mg/kg mỗi ngày (tối đa 80 mg/ngày) hoặc 2mg/kg mỗi 2 ngày (tối đa 120mg mỗi 2 ngày) dùng tối thiểu 4 tuần và tối đa 16 tuần (nếu dung nạp). Sau khi thuyên giảm, giảm liều dần trong vòng ít nhất 24 tuần. | |
Khởi trị khi có chống chỉ định glucocorticoid Cyclophosphamide đường uống Cyclosporine Tacrolimus | 2-2,5 mg/kg/ngày trong 8 tuần 3-5 mg/kg/ngày, dùng nhiều lần/ngày trong 1-2 năm 0,05-0,1 mg/kg/ngày, dùng nhiều lần/ngày trong 1-2 năm. | 75% 75% 90% |
Bệnh nhân tái phát thường xuyên/ phụ thuộc steroid Cyclophosphasmide đường uống • Cyclosporine • Tacrolimus • Rituximab | 2-2,5 mg/kg/ngày, chỉnh liều theo bạch cầu máu, trong 8-12 tuần. Ít tái phát hơn sau 12 tuần ở thể MCD phụ thuộc steroid. Liều khởi đầu: 3-5 mg/kg/ngày, dùng nhiều lần/ngày trong 1-2 năm 0.05-0.1 mg/kg/ngày, dùng nhiều lần/ngày trong 1-2 năm. • Nếu có theo dõi nồng độ trong huyết thanh, nồng độ khởi trị khuyến cáo: - Cyclosporine: 150-200 ng/ml (125-166nmol/l) - Tacrolimus: 4-7 ng/ml (5-8.7 nmol/l) • Sau khi ngưng glucocorticoid, giảm liều CNI nếu có thể Liều đề xuất: < 3 mg/kg/ngày đối với Cyclosporine và < 0,05 mg/kg/ngày đối với tacrolimus. • Thử giảm liều dần dần và ngưng CNI sau tối thiểu 1 năm điều trị (nếu có thể). • Nếu phụ thuộc CNI, giảm liều tới liều thấp nhất có thể để duy trì thuyên giảm và theo dõi chức năng thận (sinh thiết thận nếu có giảm chức năng thận). Đối sang thuốc thay thế nếu có bằng chứng nhiễm độc CNI. Phát đồ ban đầu: • 375 mg/m² da x 1 liều/ tuần x 4 tuấn. • 375 mg/m² da x liều duy nhất, lặp lại sau 1 tuần nếu tế bào CD19 > 5/mm³. • 1 g/lần x 2 lần cách nhau 2 tuần Tái phát sau khởi trị: • 375 mg/m² da x 1 liều hoặc • 1g tiêm tĩnh mạch x 1 liều. Liều khởi đầu: 1000 mg 2 lần/ ngày. 720 mg 2 lần/ ngày. • Thử giảm dần liều và ngưng các chất tương tự acid mycophenolic sau ít nhất 1 năm điều trị (nếu có thể) | 75% 70-90% 90% 70% (20% tất cả thuốc ức chế miễn dịch, 50% đối với 1 thuốc ức chế miễn dịch khác) |
5.3.1 Điều trị tái phát (bảng 11)
Bảng 11. Định nghĩa về thuyên giảm, tái phát, kháng thuốc và phụ thuộc thuốc với MCD.
| Thuyên giảm hoàn toàn |
| Giảm protein niệu <0,3 g/dl hoặc PCR <300 mg/g (hoặc< 30 mg/mmol), creatinine huyết thanh và albunin huyết thanh ổn định (với albumin > 3,5 g/dl ( hoặc 35 g/l)) |
| Thuyên giảm một phần |
| Giảm protein niệu từ 0,3-3,5 g/ngày hoặc PCR 300-3500 mg/g (hoặc 30-350 mg/mmol) và giảm >50% giá trị nền |
| Tái phát |
| Protein niệu > 3,5 g/ngày hoặc PCR >3500 mg/g (hoặc 350 mg/mmol) sau khi đạt thuyên giảm hoàn toàn |
| MCD kháng steroid |
| Protein niệu dai dẳng >3,5 g/ngày hoặc PCR > 3500 mg/g (hoặc 350 mg/mmol) và giảm <50% so với mức nền mặc dù đã điều trị với Prednisolone 1 mg/kg/ngày hoặc 2 mg/kg cách ngày trong >16 tuần |
| MCD tái phát thường xuyên |
| Tái phát ≥ 2 lần trong 6 tháng (hoặc tái phát ≥ 4 lần trong 12 tháng) |
| MCD phụ thuộc steroid |
| Tại phát xảy ra trong suốt liệu trình hoặc trong vòng 2 tuần sau khi hoàn thành liệu pháp glucocorticoid |
PCR: tỉ protein/creatinine.
Quan điểm thực hành 5.3.1.1: Sơ đồ điều trị MCD tái phát thường xuyên (FR)/phụ thuộc steroid (SD) ở người lớn. (Hình 12)

Việc lựa chọn thuốc nên dựa vào bác sĩ điều trị và mong muốn của bệnh nhân. FR/SD: Tái phát thường xuyên/phụ thuộc steroid (frequently relapsing/steroid- dependent).
Quan điểm thực hành 5.3.1.2: Điều trị các đợt tái phát không thường xuyên bằng glucocorticoids (bảng 11).
Khuyến cáo 5.3.1.1: Thay vì dùng prednisone đơn trị hoặc không điều trị, khuyến cáo nên dùng cyclophosphamide, rituximab, chất ức chế calcineurin (CNI), hoặc các chế phẩm tương tự acid mycophenolic (MPAA) để điều trị MCD tái phát thường xuyên/MCD phụ thuộc steroid (1C)
1.4 CHƯƠNG 6: XƠ HÓA CẦU THẬN Ở ĐOẠN (FSGS) Ở NGƯỜI LỚN
1.4.1 Chẩn đoán
Sự khác nhau giữa FSGS nguyên phát và thứ phát
Quan điểm thực hành 6.1.1.1: Nên đánh giá một nguyên nhân thứ phát ở người lớn mắc FSGS mà không có hội chứng thận hư (hình 13, bảng 12)

Bảng 12. Các nguyên nhân của FSGS thứ phát.
| Thứ phát sau sự thay đổi của các tế bào biểu mô cầu thận | |
| Nhiễm virus | HIV (đã xác nhận) CMV (có khả năng) Parovirus B19, EBV, HCV (có khả năng) SARS-COV2 (với kiểu gen nguy cơ APOL1) |
| Do thuốc | Liệu pháp kháng virus trực tiếp Thuốc ức chế mTOR, CNIs Anthracychines Heroin (tạp chất) Lithium Interferon Anabolic steroids NSAIDS |
| Thứ phát sau những thay đổi thích nghi với tăng áp lực cầu thận | |
| Giảm số lượng nephron | Bệnh thận trào ngược (reflux nephropathy) Loạn sản thận Thiếu sản và giảm các nephrons (oligomeganephronia) Bệnh hồng cầu hình liềm FSGS liên quan đến tuổi |
| Số lượng nephron bình thường | Bệnh cầu thận do béo phì Bệnh cầu thận tiên phát Bệnh toàn thân, ví dụ: bệnh thận đái tháo đường, xơ hóa cầu thận do tăng huyết áp |
APOL1: apolipoprotein L1; CMV: cytomegalovirus; CNI: chất ức chế calciurein; EBV: virus Epstein Barr; HCV: virus viêm gan C; HIV: virus suy giảm miễn dịch ở người
Bảng 13. Tiêu chuẩn thuyên giảm, tái phát, để kháng, phụ thuộc trong FSGS.
| Thuyên giảm hoàn toàn |
| Giảm protein niệu < 0,3 g/ngày hoặc PCR < 300 mg/g (hoặc <30 mg/mmol), creatinin huyết thanh ổn định và albumin huyết thanh > 3,5g/dL (hoặc 35g/L) |
| Thuyên giảm một phần |
| Giảm protein niệu từ 0,3-3,5 g/ngày hoặc PCR 300-3500 mg/g (hoặc 30-350 mg/mmol) và giảm > 50% so với mức nền |
| Tái phát |
| Protein niệu > 3,5 g/ngày hoặc PCR > 3500 mg/g (hoặc 350mg/mmol) sau khi đạt được thuyên giảm hoàn toàn hoặc tăng protein niệu > 50% sau khi đạt thuyên giảm một phần. |
| FSGS để kháng Steroid |
| Protein niệu kéo dài > 3,5 g/ngày hoặc PCR > 3500 mg/g (hoặc 350 mg/mmol) và giảm < 50% so với mức nền mặc dù đã điều trị bằng prednisone 1mg/kg/ngày hoặc 2mg/kg cách ngày trong > 16 tuần |
| FSGS phụ thuộc Steroid |
| Tái phát xảy ra trong suốt liệu trình hoặc trong vòng 2 tuần sau khi kết thúc liệu pháp glucocorticoid |
| FSGS để kháng chất ức chế Calcineurin |
| Protein niệu kéo dài > 3,5 g/ngày hoặc PCR > 3500 mg/g (hoặc 350 mg/mmol) và giảm < 50% so với mức nền mặc dù đã điều trị bằng cyclosporine đạt mục tiêu nồng độ thấp nhất 100-175 ng/ml (83-146 nmol/l) hoặc điều trị tacrolimus đạt mục tiêu nồng độ thấp nhất 5-10 ng/ml (6-12 nmol/l) trong 4-6 tháng |
| FSGS phụ thuộc chất ức chế Calcineurin |
| Tái phát xảy ra trong suốt liệu trình hoặc trong vòng 2 tuần sau khi kết thúc liệu pháp cyclosporine hoặc tacrolimus trong > 12 tháng |
Xét nghiệm di truyền
Quan điểm thực hành 6.1.2.1; Ở một số bệnh nhân FSGS, có thể có lợi khi xét nghiệm di truyền và bệnh nhân nên được chuyển đến trung tâm chuyên sâu có nhiều chuyên môn (bảng 14)
Bảng 14. Giá trị của xét nghiêm di truyền ở những bệnh nhân FSGS.
| Các thế di truyền của FSGS | |
| Các đột biến di truyền của tế bào có chân và protein màng đáy cầu thận |
|
| Cân nhắc xét nghiệm di truyền ở người lớn có FSGS | |
| |
1.4.2 Điều trị
Điều trị FSGS-chưa xác định rõ căn nguyên (FSGS-UC) và FSGS thứ phát
Quan điểm thực hành 6.2.1.1: Không nên dùng thuốc ức chế miễn dịch cho người lớn có FSGS chưa xác định rõ căn nguyên (FSGS-UC), hoặc FSGS thứ phát.
Điều trị ban đầu cho FSGS nguyên phát
Khuyến cáo 6.2.2.1: Sử dụng glucocorticoid đường uống liều cao là liệu pháp ức chế miễn dịch đầu tay cho FSGS nguyên phát (1D)
Quan điểm thực hành 6.2.2.1: Liều glucocorticoid khi khởi trị FSGS nguyên phát được khuyến cáo trong bảng 15
Quan điểm thực hành 6.2.2.2: Nên tiếp tục sử dụng liều cao glucocorticoids ban đầu cho đến khi bệnh thuyên giảm hoàn toàn hoặc bệnh nhân dung nạp (tối đa 16 tuần và tùy theo thời điểm nào đến sớm hơn).
Quan điểm thực hành 6.2.2.3: Người lớn FSGS nguyên phát có đáp ứng với điều trị glucocorticoid thì nên kéo dài liệu pháp ≥ 6 tháng.
Quan điểm thực hành 6.2.2.4: Đối với người lớn chống chỉ định tương đối hoặc không dung nạp với glucocorticoid, cân nhắc liệu pháp thay thế chất ức chế calcineurin như là liệu pháp đầu tay ở những bệnh nhân FSGS (bảng 15)
Bảng 15. Điều trị ban đầu cho FSGS nguyên phát
| Điều trị | Liều lượng và thời lượng |
| Glucocorticoids | Liều ban đầu Liệu pháp glucocorticoid liều cao với prednisone liều đơn 1 mg/kg/ngày (tối đa 80mg) hoặc liều 2 mg/kg mỗi 2 ngày (tối đa 120mg) |
Thời gian điều trị glucocorticoid liều cao
| |
Giảm liều glucocorticoid
| |
Chất ức chế calcineurin | Liều ban đầu
|
Thời gian điều trị để xác định hiệu quả CNI Nên tiếp tục dùng cyclosporine hoặc tacrolimus đến liều đạt mục tiêu nồng độ thấp nhất trong máu tối thiểu 4-6 tháng, trước khi cân nhắc bênh nhân có kháng CNI | |
Tổng thời gian điều trị
|
* Đối với CNI, thường sử dụng 2 lần/ngày và có thể được dùng 1 lần/ngày phụ thuộc vào bác sĩ. Nồng độ CNI trong máu không phản ánh về nồng độ thuốc trong tế bào. Hiện tại, liều thích hợp nhất cho CNI là có thể chỉnh liều trên từng bệnh nhân để đạt được hiệu quả mong muốn về protein niệu, cân bằng giữa tăng liều so với creatinin huyết thanh và giảm liều nếu creatinin huyết thanh tăng nhưng không ổn định hoặc tăng trên 30% so với mức nền. Nếu nồng độ creatinin vẫn tăng sau giảm liều, nên ngừng CNI.
1.4.3 Những tình huống đặc biệt
FSGS nguyên phát kháng steroid
Khuyến cáo 6.3.1.1: Ở người lớn có FSGS nguyên phát kháng steroid, khuyến cáo sử dụng cyclosporine hoặc tacrolimus ≥ 6 tháng thay vì tiếp tục glucocorticoids đơn trị liệu hoặc không điều trị (1C).
Lộ trình liều cho cyclosporine và tacrolimus
Quan điểm thực hành 6.3.2.1: Điều trị FSGS nguyên phát kháng steroid: liều lượng của cyclosporine và tacrolimus được trình bày trong bảng 16
Bảng 16. Điều trị FSGS nguyên phát kháng glucocorticoids.
| Điều trị | Liều lượng và thời gian |
| Chất ức chế calcineurin* | Liều bắt đầu
|
Tổng thời gian điều trị CNI
| |
| Không dung nạp hoặc chống chỉ định với chất ức che calcineurin |
|
* Đối với CNI, thường sử dụng 2 lần/ngày và có thể được dùng 1 lần/ ngày phụ thuộc vào bác sĩ. Nồng độ CNI trong máu không phản ánh về nồng độ thuốc trong tế bào. Hiện tại, liều thích hợp nhất cho CNI là có thể chỉnh liều trên từng bệnh nhân để đạt được hiệu quả mong muốn về protein niệu, cân bằng giữa tăng liều so với creatinin huyết thanh và giảm liều nếu creatinin huyết thanh tăng nhưng không ổn định hoặc tăng trên 30% so với mức nền. Nếu nồng độ creatinin vẫn tăng sau giảm liều, nên ngừng CNI.
Thời gian điều trị CNI
Quan điểm thực hành 6.3.3.1: Bệnh nhân người lớn với FSGS nguyên phát kháng steroid mà có đáp ứng với điều trị CNI, tiếp tục CNI trong ít nhất 12 tháng để giảm thiểu nguy cơ tái phát (bảng 16)
Bệnh nhân kháng hoặc không dung nạp CNI
Quan điểm thực hành 6.3.4.1: Bệnh nhân người lớn với FSGS nguyên phát kháng steroid có: đề kháng hoặc không dung nạp với CNI thì nên chuyển đến các trung tâm chuyên sâu để cân nhắc lặp lại sinh thiết, điều trị thay thế hoặc đăng kí tham gia thử nghiệm lâm sàng. (bảng 16)
Quản lý tái phát
Quan điểm thực hành 6.3.5.1: Có thể dùng phác đồ tương tự như người lớn mắc MCD tái phát (hình 12) ở bệnh nhân người lớn FSGS nguyên phát nhạy cảm với steroid mà đã xảy ra một đợt tái phát.
1.5 CHƯƠNG 7: VIÊM CẦU THẬN NHIỄM TRÙNG
1.5.1 Viêm cầu thận nhiễm trùng do vi khuẩn (bacterial infection-related GN)
Chẩn đoán
Quan điểm thực hành 7.1.1: Sinh thiết thận có thể hữu ích trong trường hợp nghi ngờ viêm cầu thận nhiễm trùng do vi khuẩn; đặc biệt khi không rõ ràng về bằng chứng nuôi cấy hay chẩn đoán còn nghi ngờ, để đánh giá tiên lượng, và/hoặc có cơ sở đưa ra liệu pháp điều trị. Trong một số trường hợp, sinh thiết có thể quan trọng để đưa đến chẩn đoán xác định khi nhiều bệnh đồng mắc có thể gây nhiễu. (bảng 17)
Bảng 17. Các hội chứng viêm cầu thận do nhiễm khuẩn kinh điển.
| Viêm cầu thận sau nhiễm trùng | Viêm cầu thận shunt | Viêm cầu thận do viêm nội tâm mạc | Viêm cầu thận nhiễm trùng do lắng đọng chủ yếu IgA | |
| Nguy cơ và đặc điểm nguy cơ | Trẻ em, người già, người suy giảm miễn dịch, môi trường sống kém vệ sinh | - Cao nhất: Dẫn lưu não thất tâm nhĩ - Trung bình: Dẫn lưu não thất- cảnh - Thấp nhất: Dẫn lưu não thất- phúc mac | Tổn thương cấu trúc van tim và van nhân tạo; lạm dụng chất kích thích; đái tháo đường; virus viêm gan C; HIV (gây suy giảm miễn dịch vật chủ) | Đái tháo đường, Tăng huyết áp, Bệnh tim mạch, bệnh lý ác tính, lạm dụng rượu và chất kích thích, hoặc ghép thận. |
| Tiền sử | Sau nhiễm khuẩn hầu họng (1-2 tuần) hay nhiễm khuẩn ngoài da (4-6 tuần) | Có thể xuất hiện trong vài tháng hoặc vài thập kỉ sau khi đặt dẫn lưu, đôi khi xuất hiện sau khi sửa chữa dẫn lưu. Chẩn đoán có thể nhầm lẫn và khó khăn trong 40% trường hợp có nhiễm trùng | Bằng chứng mảnh sùi van tim qua siêu âm tim | Có bằng chứng nhiễm trùng máu hoặc mô ở bệnh nhân viêm cầu thận cấp |
| Thăm khám lâm sàng | Trong một số trường hợp, đang có nhiễm khuẩn da và viêm amidan | Triệu chứng cơ năng và thực thể của nhiễm trùng không đặc hiêu, hôn mê, sốt, dấu hiệu lâm sàng của nhiễm khuẩn huyết. | Sốt, tiếng tim mới xuất hiện hoặc thay đổi | Tăng huyết áp thường thăm xuyên, khám thường phát hiện rõ vị trí và mức độ nghiêm trọng của nhiễm trùng. |
| Xét nghiệm về thận |
| |||
| Xét nghiệm về nhiễm trùng | Nuôi cấy da hoặc amidan nếu nhiễm trùng. Định lượng kháng thể kháng liên cầu, kháng the DNAse B, kháng thể kháng Hyaluronidase. | Cấy máu, dịch não tủy, ống thông (sau khi loại bỏ) | Cấy máu dương tính 90- 98%, âm tính 2-10%. Các trường hợp khó mọc như: Candida, Coxiella burnetiid, Borrelia, và Bartonella có thể khó để nuôi cấy. Các xét huyết thanh có thể cần thiết trong những trường hợp này. | Cấy máu hoặc nuôi cấy mô để xác định nhiễm khuẩn (chủ yếu là Staphylococcal) |
| Xét nghiệm miễn dịch |
| |||
| Nồng độ IgA huyết thanh có the cao | ||||
ACR: tỷ albumin/creatinin niệu, ANA: kháng thể kháng nhân; ANCA: kháng thể kháng tương bào bạch cầu đa nhân trung tính; eGFR: mức lọc cầu thận ước tính; HIV, virus gây suy giảm miễn dịch ở người; PCR, tỷ protein/creatinin niệu; PR3: proteinase 3 (PR3); GBM: màng đáy cầu thận.
Tiên lượng và điều trị
Quan điểm thực hành 7.1.2.1: Tiên lượng và điều trị cho viêm cầu thận nhiễm trùng do vi khuẩn (bảng 18).
Bảng 18. Tiên lượng và điều trị các thể hội chứng viêm cầu thận do nhiễm khuẩn
| Viêm cầu thận sau nhiễm trùng | Viêm thận shunt | Viêm cầu thận do viêm nội tâm mạc nhiễm khuẩn | Viêm cầu thận do nhiễm trùng do lắng đọng chủ yếu lgA | |
| Tiên lượng | Tiên lượng gần ở trẻ em là rất tốt. Ở vùng bênh lưu hành, albumin niệu có thể xuất hiện kéo dài và một số người lớn có eGFR thấp. Ở bệnh nhân lớn tuốt chức năng thận xấu đi ở người có albumin niệu kéo dài; tỷ lệ tử vong có thể lên tới 20% | Tiên lượng tốt khi được chẩn đoán và điều trị nhiễm trùng kịp thời. Hầu hết bệnh nhân hồi phục chức năng thận nhưng một số vẫn còn vết tích của bệnh thận mạn. | Tiên lượng gần là tốt khi loại bỏ ổ nhiễm trùng. Một số trường hợp có thể cần phải thay van | Cần lọc máu thường xuyên trong bối cảnh cấp tính. Hồi phục hạn chế, ít hơn 20% trường hợp hổi phục được chức năng thận ban đầu. |
| Điều trị | - Không có thử nghiệm lâm sàng ngẫu nhiên có đối chứng nào hướng dẫn điều trị những bệnh nhân trên. - Kháng sinh cho trường hợp có căn nguyên nhiễm trùng (mặc dù không làm thay đổi diễn biến viêm cầu thận sau nhiễm trùng) theo vùng dịch tễ vi khuẩn. Có thể dùng kháng sinh trong trường hợp viêm cầu thận sau nhiễm liên cầu nếu nuôi cấy có Streptococci ở bất kì vị trí nào. Đây là việc làm đầu tay để ngăn chặn sự lây lan nhiễm trùng trong cộng đồng. - Điều trị phù và tăng huyết áp,... cũng như điều trị protein kéo dài và/hoặc suy giảm eGFR tiến triển như ở Chương 1 | |||
| Lợi ích của glucocorticoid liều cao vẫn chưa được chứng minh | Thay thế phần lớn các dẫn lưu có ít nguy cơ nhiễm trùng hơn. Hiếm khi chỉ định phẫu thuật tạo lỗ thông khoang não thất sau khi loại bỏ dẫn lưu | Lợi ích của glucocorticoid và thuốc ức chế miễn dịch vẫn chưa được chứng minh và có thế mang đến nguy cơ tiềm tàng nghiêm trọng, ngay cả khi trong trường hợp viêm câu thận liềm (crescentic GN) | Đối với trường hợp suy giảm chức năng thận nghiêm trọng, nên cân nhắc nguy cơ và lợi ích của liệu pháp ức chế miên dịch. Nguy cơ nhiẻm trùng và các biến chứng khi dùng glucocorticoid thường xảy ra ở nhóm người cao tuổi kèm nhiều bệnh đồng mắc có thể rất lớn. Vai trò của liệu pháp ức chế miễn dịch vẫn còn chưa được chứng minh rõ ràng, do vậy không nên sử dụng thường quy. | |
| Diễn biến | Theo dõi chức năng thận, bổ thể C3 C4 trong máu, nước tiểu, ACR, protein niệu trong khoảng thời gian thích hợp cho đến khi thuyên giảm hoặc hồi phục hoàn toàn | |||
Nồng độ bổ thể C3 thấp kéo dài hơn 12 tuần có thể là một chỉ định của sinh thiết thận để loại trừ C3 GN. Dự phòng bệnh dịch viêm cầu thận sau nhiễm liên cầu có thể bao gồm can thiệp kinh tế xã hội và sử dụng kháng sinh lượng lớn để cải thiện điều kiện sống và hạn chế lây lan sự viêm nhiễm ở nhóm người có tỷ lệ hiện hành nhiễm liên cầu nhóm A và bệnh ghẻ cao. | Tiền sử bẩm sinh có PR3- ANCA ở một số bệnh nhân chưa rõ ràng và cần thiết theo dõi. | Tiên lượng tốt nếu ổ nhiễm trùng có thể được xác định và loại bỏ kịp thời. | Tiên lượng khả năng phục hồi kém ở bệnh nhân có Đái tháo đường. | |
ACR: tỉ albumin niệu/creatinine niệu; ANCA: kháng thể kháng thương bào đoạn bạch cầu đa nhân trung tính; C3 GN: viêm cầu thận C3; GN: viêm cầu thận; PR3: proteinase 3;
1.5.2 Viêm cầu thận do nhiễm virus
1.5.3 Viêm cầu thận do nhiễm virus viêm gan C
Hiệp hội tán thành các khuyến cáo 5.1-5.2.3 của Hướng dẫn thực hành lâm sàng KDIGO 2018 về dự phòng, chẩn đoán, đánh giá, và điều trị viêm gan virus C trong bệnh thận mạn. Vui lòng tham khảo tài liệu này biết các khuyến cáo cụ thể, lựa chọn, và liều thuốc điều trị đặc hiệu.
Viêm cầu thận do nhiễm virus viêm gan B
a. Chẩn đoán
Quan điểm thực hành 7.2.2.1.1: Nên kiểm tra nhiễm virus viêm gan B ở bệnh nhân bệnh cầu thận có protein niệu.
b. Tiên lượng
Quan điểm thực hành 7.2.2.2.1: Xem xét nguy cơ tiến triển suy thận ở bệnh nhân người lớn có viêm gan virus B mạn tính.
c. Điều trị
Khuyến cáo 7.2.2.3.1: Khuyến cáo những bệnh nhân nhiễm virus viêm gan B giai đoạn hoạt động (khi tải lượng HBV DNA > 2000 IU/mL) và viêm cầu thận: điều trị bằng các thuốc tương tự nucleotide như đã khuyến cáo cho dân số chung trong hướng dẫn thực hành lâm sàng tiêu chuẩn (1C).
Quan điểm thực hành 7.2.2.3.1: Không nên sử dụng phác đồ pegylated Interferon (Peginterferon) để điều trị cho bệnh nhân nhiễm virus viêm gan B giai đoạn hoạt động có viêm cầu thận.
Quan điểm thực hành 7.2.2.3.2: Các chế phẩm ức chế miễn dịch như cyclophosphamide hay rituximab có thể làm tăng khả năng nhân đôi virus viêm gan B ở bệnh nhân viêm cầu thận, do vậy nên tránh khi virus viêm gan B ở giai đoạn hoạt động mà không được điều trị thuốc kháng virus.
d. Những tình huống đặc biệt
Quan điểm thực hành 7.2.2.4.1: Nên tránh sử dụng rituximab và cyclophosphamide ở bệnh nhân đồng thời có nhiễm virus viêm gan B và bệnh cầu thận màng do kháng thể kháng PLA2R cho đến khi thuyên giảm về mặt virus một cách bền vững với các thuốc tương tự nuclotide.
Quan điểm thực hành 7.2.2.4.2: Thay huyết tương có thể thực hiện ở bệnh nhân có viêm mạch cryglobulin đi kèm.
Quan điểm thực hành 7.2.2.4.3: Nên điều trị bảo tồn mà không cần thuốc ức chế miễn dịch ở trẻ em nhiễm virus viêm gan B và bệnh cầu thận màng do khả năng cao xảy ra thuyên giảm bệnh tự phát.
Viêm cầu thận do virus gây suy giảm miễn dịch ở người (HIV)
a. Chẩn đoán
Quan điểm thực hành 7.2.3.1.1: Nên chỉ định sinh thiết thận (khi có thể) để đánh giá hình thái mô học của bệnh thận do HIV. Mô tả bệnh thận do HIV dựa trên bệnh học nên được sử dụng để giúp xác định và hướng dẫn điều trị.
b. Tiên lượng
Quan điểm thực hành 7.2.3.2.1: Các yếu tố góp phần vào kết cục lâu dài của bệnh cầu thận do nhiễm HIV là rất nhiều và bao gồm: sự nhân lên dai dẳng của virus, đáp ứng với thuốc kháng virus, khuynh hướng di truyền tổn thương cầu thận (ví dụ, alen nguy cơ APOL1), đồng nhiễm với những virus khác và sự phát triển của bệnh phức hợp miễn dịch và bệnh vi mạch huyết khối. Do đó, việc ước tính tiên lượng ở mỗi bệnh nhân có thể rất khó.
c. Điều trị
Khuyến cáo 7.2.3.3.1: Khuyến cáo khởi trị liệu pháp kháng virus ở tất cả bệnh nhân có HIV và bệnh thận mạn, đặc biệt bệnh thận do HIV đã được chứng minh trên sinh thiết (HIVAN), bất kể số lượng tế bào CD4, và điều chỉnh liều theo mức lọc cầu thận (1C).
Quan điểm thực hành 7.2.3.3.1: Quyết định sử dụng glucocorticoid như liệu pháp hỗ trợ cho HIVAN phải được thực hiện trên từng trường hợp cụ thể, vì nguy cơ và lợi ích lâu dài chưa rõ ràng.
1.5.4 Bệnh thận do nhiễm sán máng, giun chỉ, và sốt rét
Bệnh thận sán mán
a. Chẩn đoán
Quan điểm thực hành 7.3.1.1.1: Cần kiểm tra một số tác nhân đồng nhiễm lưu hành (Salmonella, HBV, HCV, HIV), vì mục tiêu điều trị có thể thay đổi khi có bệnh lí viêm cầu thận bên dưới hoặc di chứng của sán máng.
Quan điểm thực hành 7.3.1.1.2: Tiến hành sinh thiết thận ở bệnh nhân nghi ngờ có viêm cầu thận do sán máng trong sự hiện diện đồng nhiễm virus (HBV, HCV, HIV).
b. Điều trị
Quan điểm thực hành 7.3.1.2.1: Điều trị bệnh nhân nhiễm sán máng có viêm cầu thận bằng thuốc diệt ký sinh trùng đầy đủ và thích hợp về liều lượng và thời gian. Không có chỉ định dùng thuốc ức chế miễn dịch cho bệnh thận sán máng.
c. Những tình huống đặc biệt
Quan điểm thực hành 7.3.1.3.1: Theo dõi tiến triển của bệnh thận ở bệnh nhân xơ hóa gan do sán máng
Quan điểm thực hành 7.3.1.3.2: Đánh giá ung thư bàng quang và/hoặc bệnh lí tắc nghẽn đường tiết niệu ở bệnh nhân có tiền sử nhiễm sán máng và creatinin huyết thanh cao và/hoặc hồng cầu niệu
Bệnh cầu thận và giun chỉ
a. Điều trị
Quan điểm thực hành 7.3.2.1.1: Điều trị bệnh nhân nhiễm giun chỉ có viêm cầu thận bằng thuốc diệt ký sinh trùng đầy đủ và thích hợp về liều lượng và thời gian. 7.3.3 Bệnh thận sốt rét
b. Điều trị
Quan điểm thực hành 7.3.3.1.1; Điều trị bệnh nhân nhiễm sốt rét có viêm cầu thận bằng thuốc diệt ký sinh trùng đầy đủ và thích hợp về liều lượng và thời gian. Không có chỉ định dùng thuốc ức chế miễn dịch cho bệnh thận sốt rét.
1.6 Chương 10: Bệnh thận lupus
1.6.1 Chẩn đoán

Quan điểm thực hành 10.1.1: Tiếp cận chẩn đoán tổn thương thận trong Lupus ban đỏ hệ thống (SLE) (hình 14)
1.6.2 Điều trị
Quản lý chung bệnh nhân có bệnh thận lupus
Khuyến cáo 10.2.1.1: Khuyến cáo bệnh nhân SLE (bao gồm cả những người viêm thận lupus (LN)), nên được điều trị bằng hydroxychloroquine hoặc thuốc chống sốt rét tương đương trừ khi có chống chỉ định (1C).
Quan điểm thực hành 10.2.1.1: Các liệu pháp hỗ trợ để quản lý viêm thận lupus (LN) bao gồm làm giảm các biến chứng của bệnh hoặc các phương pháp điều trị bệnh cần cân nhắc cho tất cả các bệnh nhân (bảng 19).
Bảng 19. Các biện pháp nhằm giảm thiểu nguy cơ biến chứng liên quan đến LN hoặc các liệu pháp điều trị của bệnh
| Nguy cơ | Giảm thiểu nguy cơ |
| Nguy cơ tim mạch | • Thay đổi lối sống - ngừng hút thuốc, cần tối ưu hóa trọng lượng cơ thể. tâp thể dục • Quản lý rối loạn lipid máu • Aspirin liều thấp trong khi mang thai |
| Protein niệu Xem chương 1 | • Tránh chế độ ăn giàu natri • Kiểm soát huyết áp • Ức chế hệ RAA |
| Nguy cơ nhiễm trùng | • Đánh giá tiền sử mắc herpes zoster (zona thần kinh) và lao • Sàng lọc để chủng ngừa HBV, HCV, HIV và tiêm vaccine HBV • Phòng ngừa Pneumocystis jirovecii (vấn đề về tác dụng phụ của thuốc được thảo luận bên dưới) • Tiêm phòng cúm và phế cầu • Cá thể hóa việc sử dụng đối với vaccine zoster tái tổ hợp • Cân nhắc cá thể hóa tại thời điểm điều trị với một số bệnh truyền nhiễm được xem như vấn đề sức khỏe của cộng đồng |
| Tổn thương xương | • Đánh giá mật độ khoáng của xương và nguy cơ gãy xương • Bổ sung Canxi và vitamin D • Bisphosphonates khi cần thiết |
| Tiếp xúc với tia cực tím | • Kem chống nắng trên diện rộng • Hạn chế tiếp xúc với tia cực tím |
| Suy buồng trứng sớm | • Chủ vận của hormon giải phóng kích dục tố (GRHA) (như leuprolide) • Bảo quản đông lạnh tinh trùng/ tế bào trứng |
| Mang thai ngoài kế hoạch | Đánh giá và tư vấn cá nhân về các loại biện pháp tránh thai ( dựa trên sở thích, nguy cơ huyết khối, tuổi) |
| Ung thư | • Đánh giá các yếu tố nguy cơ riêng lẻ với các bệnh ác tính • Sàng lọc các bệnh ác tính theo tuổi • Hạn chế phơi nhiễm cyclophosphamide ởmức<36g suốt đời |
Bệnh thận lupus loại I hoặc loại II
Quan điểm thực hành 10.2.2.1: Tiếp cận liệu pháp ức chế miễn dịch cho bệnh nhân bệnh thận lupus loại I hoặc loại II (hình 15)

1.6.3 Bệnh thận lupus loại III hoặc loại IV
a. Khởi trị bệnh thận lupus loại III/IV đang hoạt động
Khuyến cáo 10.2.3.1.1: Khuyến cáo khởi trị bằng glucocorticoid kết hợp với cyclophosphamide liều thấp đường tĩnh mạch hoặc chất tương tự acid mycophenolic (MPAA) ở những bệnh nhân có LN loại III hoặc IV đang hoạt động (có hoặc không bổ thể màng) (1B).
Quan điểm thực hành 10.2.3.1.1: Trong viêm thận lupus đang hoạt động, sau khi khởi trị bằng methylprednisolone pulse ngắn ngày nếu các triệu chứng tại thận và ngoài thận cải thiện đáng kể thì có thể cân nhắc giảm dần liều glucocorticoid (bảng 20).
Bảng 20. Ví dụ về phác đồ glucocorticoid cho viêm thận lupus.
| Phác đồ cho liều tiêu chuẩn | Phác đồ cho liều trung bình | Phác đồ cho liều thấp | |
| Methylprednisolone pulses tiêm tĩnh mạch | Điều trị ban đầu: Không hoặc bắt đầu 0,25-0,5 g/ngày (tối đa 3 ngày) | Điều trị ban đầu: 0,25-0,5 g/ngày (tối đa 3 ngày) | Điều trị ban đầu: 0,25-0,5 g/ngày (tối đa 3 ngày) |
| Liều prednisone đường uống (/ngày) hoặc tương đương | |||
| Tuần 0-2 | 0,8-1,0 mg/kg (liều tối đa 80mg) | 0,6-0,7 mg/kg (liều tối đa 50mg) | 0,5-0,6 mg/kg (liều tối đa 40mg) |
| Tuần 3-4 | 0,6-0,7 mg/kg | 0,5-0,6 mg/kg | 0,3-0,4 mg/kg |
| Tuần 5-6 | 30 mg | 20 mg | 15 mg |
| Tuần 7-8 | 25 mg | 15 mg | 10 mg |
| Tuần 9-10 | 20 mg | 12.5 mg | 7.5 mg |
| Tuần 11-12 | 15 mg | 10 mg | 5 mg |
| Tuần 13-14 | 12.5 mg | 7.5 mg | 2.5 mg |
| Tuấn 15-16 | 10 mg | 7.5 mg | 2.5 mg |
| Tuần 17-18 | 7.5 mg | 5 mg | 2.5 mg |
| Tuần 19-20 | 7.5 mg | 5 mg | 2.5 mg |
| Tuần 21-24 | 5 mg | <5 mg | 2.5 mg |
| Tuấn >25 | < 5 mg | <5 mg | <2.5 mg |
Quan điểm thực hành 10.2.3.1.2: Ở những bệnh nhân gặp khó khăn trong việc tuân thủ phác đồ đường uống, có thể khởi trị cyclophosphamide đường tĩnh mạch cho LN loại III và loại IV đang hoạt động.
Quan điểm thực hành 10.2.3.1.3: Ưu tiên khởi trị với phác đồ dựa trên MPAA đối với viêm thận lupus tăng sinh cho: những bệnh nhân có nguy cơ vô sinh ở mức cao, những bệnh nhân có phơi nhiễm với cyclophosphamide liều trung bình đến cao trước đó, và bệnh nhân gốc châu Á, gốc Tây Ban Nha hoặc gốc Phi.
Quan điểm thực hành 10.2.3.1.4: Khởi trị với phác đồ ức chế miễn dịch bộ ba bao gồm CNI (tacrolimus hoặc cyclosporine) cùng với MPAA liều thấp và glucocorticoid: cho những bệnh nhân không dung nạp MPAA liều tiêu chuẩn hoặc không thích hợp hoặc sẽ không sử dụng phác đồ dựa trên cyclophosphamide.
Quan điểm thực hành 10.2.3.1.5: Đối với những bệnh nhân có eGFR nén ≥ 45 mL/phút/1.73 m², có thể thêm voclosporin với MPAA và glucocorticoid như phác đồ điều trị ban đầu trong 1 năm.
Quan điểm thực hành 10.2.3.1 Liệu pháp sinh học đích tế bào lympho trong điều trị viêm thận lupus mới nổi gần đây. Có thể thêm belimumab vào liệu pháp tiêu chuẩn trong điều trị viêm thận lupus đang hoạt động. Có thể cân nhắc rituximab cho những bệnh nhân có đợt bệnh hoạt động dai dẳng hoặc đợt bùng phát tái diễn.
Quan điểm thực hành 10.2.3.1.7: Có thể xem xét các liệu pháp khác (chẳng hạn như Azathioprine hoặc Leflunomide kết hợp với glucocorticoid) thay cho các loại thuốc ban đầu được khuyến cáo cho viêm thận lupus tăng sinh trong các tình huống như: bệnh nhân không dung nạp, thuốc không sẵn có và/hoặc chi phí quá cao của các loại thuốc tiêu chuẩn; nhưng những lựa chọn thay thế này có thể có liên quan đến việc hiệu quả điều trị kém hơn, bao gồm tăng tỷ lệ đợt bùng phát bệnh và/hoặc tăng tỷ lệ độc tính của thuốc.
b. Điều trị duy trì đối với bệnh thận lupus loại III và loại IV
Khuyến cáo 10.2.3.2.1: Khuyến cáo sau khi hoàn thành điều trị bước đầu, bệnh nhân nên được tiếp tục duy trì với MPAA (1B).
Quan điểm thực hành 10.2.3.2.1: Azathioprine là một điều trị thay thế cho MPAA sau khi hoàn thành điều trị bước đầu ở những bệnh nhân không dung nạp MPAA, những người không có khả năng tiếp cận với MPAA, hoặc những người đang cân nhắc việc mang thai.
Quan điểm thực hành 10.2.3.2.2: Nên giảm dần liều glucocorticoid đến liều thấp nhất có thể trong thời gian điều trị duy trì (trừ khi glucocorticoid dùng để điều trị cho các biểu hiện khác ngoài thận của lupus), và có thể cân nhắc việc ngừng glucocorticoid khi bệnh nhân đã duy trì được đáp ứng hoàn toàn về thận trên lâm sàng ≥ 12 tháng.
Quan điểm thực hành 10.2.3.2.3: Liều MMF trong giai đoạn đầu duy trì là khoảng 750-1000mg x 2 lần/ngày, và đối với MPA: khoảng 540-720mg x 2 lần/ngày.
Quan điểm thực hành 10.2.3.2.4: Nếu không thể sử dụng MPAA và azathioprine để duy trì, nên cân nhắc CNI hoặc mizoribine.
Quan điểm thực hành 10.2.3.2.5: Tổng thời gian điều trị ức chế miễn dịch ban đầu cộng với việc phối hợp ức chế miễn dịch duy trì đối với viêm thận lupus tăng sinh không nên < 36 tháng.
Bệnh thận lupus loại V
Quan điểm thực hành 10.2.4.1: Tiếp cận để quản lý bệnh nhân bệnh thận lupus loại V đơn thuần được trình bày trong hình 16

a. Đánh giá đáp ứng điều trị trong viêm thận lupus
Quan điểm thực hành 10.2.4.1.1: Các định nghĩa về đáp ứng với điều trị trong viêm thận lupus được đề cập trong bảng 21
Bảng 21. Các định nghĩa về đáp ứng điều trị thường được sử dụng trong LN.
| Tiêu chí | Định nghĩa |
| Đáp ứng hoàn toàn (*) | • Giảm protein niệu < 0,5 g/g (50 mg/mmol) đo bằng PCR từ mẫu nước tiểu 24 giờ • Chức năng thận ổn định hoặc cải thiện (±10% -15% so với mức nền) • Trong vòng 6-12 tháng sau khởi trị nhưng cũng có thể mất hơn 12 tháng |
| Đáp ứng một phần | • Giảm protein niệu ít nhất 50% và PCR <3 g/g (300 mg/mmol) từ mẫu nước tiểu 24 giờ • Chức năng thận ổn định hoặc cải thiện (±10%-15% so với mức nén) • Trong vòng 6-12 tháng sau khởi trị |
| Không đáp ứng | • Không đạt được đáp ứng một phần hoặc hoàn toàn trong vòng 6-12 tháng sau khởi trị |
(*) Đối với trẻ em < 18 tuổi, đáp ứng hoàn toàn được xác định khi protein niệu < 0,5 g/1.73 m²/ngày hoặc < 300 mg/m² /ngày dựa trên mẫu nước tiểu 24 giờ.
b. Quản lý bệnh nhân không đáp ứng tốt với điều trị
Quan điểm thực hành 10.2.4.2.1: Phương pháp tiếp cận có hệ thống đối với những bệnh nhân không đáp ứng tốt sau khởi trị được trình bày trong bảng 22.
Bảng 22. Quản lý những bệnh nhân không đáp ứng tốt khi khởi trị cho vi êm thận lupus đang hoạt động.
| 1 | Kiểm tra tính tuân thủ trong điều trị |
| 2 | Đảm bảo dùng đủ liều lượng thuốc ức chế miễn dịch bằng cách đo nồng độ thuốc trong huyết tương nếu có thể hoặc sẵn có (kiểm tra nồng độ axit mycophenolic nếu sử dụng các chất tương tự axit mycophenolic/ kiểm tra hồ sơ tiêm truyền nếu dùng cyclophosphamide) |
| 3 | Làm lại sinh thiết nếu lo ngại tình trạng mạn tính hoặc chẩn đoán khác (ví dụ: bệnh lý huyết khối vi mạch ) |
| 4 | Cân nhắc chuyển sang phác đồ điều trị đầu tay thay thế khi có đợt bệnh hoạt động dai dẳng (chuyển từ chất tương tự axit mycophenolic đến phác đồ dựa trên cysclophosphamide hoặc ngược lại) |
| 5 | Cân nhắc những vấn đề sau đây ở những bệnh nhân kháng với các phác đó điều trị đầu tay: • Điều trị kết hợp các chất tương tự axit mycophenolic và chất ức chế calcineurin, hoặc • Bổ sung rituximab hoặc các liệu pháp sinh học khác • Đợt điều trị bằng cyclophosphamide pulse tiêm tĩnh mạch kéo dài |
c. Điều trị bệnh thận lupus tál phát
Quan điểm thực hành 10.2.4.3.1: Sau khi đã đạt thuyên giảm hoàn toàn hoặc một phần, nếu viêm thận lupus tái phát thì điều trị giống như phác đồ ban đầu được sử dụng để đạt được đáp ứng nguyên bản hoặc khuyến cáo một liệu pháp đầu tay thay thế.
1.6.4 Những tình huống đặc biệt
Viêm thận Lupus và bệnh vi mạch huyết khối
Quan điểm thực hành 10.3.1.1: Nên điều trị theo nguyên nhân nền của bệnh vi mạch huyết khối (TMA) ở những bệnh nhân có viêm thận lupus và bệnh vi mạch huyết khối (hình 17)

ADAMTS13: một disgrin và metalloproteinase với thrombospondin type 1, thành phần 13; PLASMIC: Số lượng tiểu cầu, kết hợp biến số lọc máu, không có ung thư đang hoạt động, không có tế bào gốc hoặc cấy ghép tạng đặc, MCV, INR, Creatinine
Thai kỳ ở bệnh nhân viêm thận lupus
Quan điểm thực hành 10.3.2.1: Nên tư vấn bệnh nhân viêm thận lupus đang hoạt động tránh mang thai khi: bệnh đang hoạt động, hoặc khi đang điều trị bằng các loại thuốc có khả năng gây quái thai cao, và bệnh nhân có thể mang thai cho đến khi bệnh được kiểm soát tốt trong ít nhất 6 tháng.
Quan điểm thực hành 10.3.2.2: Để giảm nguy cơ biến chứng thai kỳ, nên tiếp tục dùng hydroxychloroquine trong khi mang thai, và aspirin liều thấp nên dùng trước 16 tuần thai.
Quan điểm thực hành 10.3.2.3: Phương pháp điều trị ức chế miễn dịch an toàn trong thai kỳ gồm: glucocorticoid, hydroxychloroquine, azathioprine và chất ức chế calcineurin.
Điều trị bệnh thận lupus ở trẻ em
Quan điểm thực hành 10.3.3.1; Điều trị bệnh nhi viêm thận lupus bằng phác đồ ức chế miễn dịch tương tự như phác đồ dùng ở người lớn nhưng cần cân nhắc các vấn đề liên quan đến trẻ chẳng hạn như điều chỉnh liều, liên quan tăng trưởng, khả năng sinh sản và các yếu tố tâm lý xã hội khi lập kế hoạch trị liệu.
Quản lý bệnh nhân lupus có suy thận
Quan điểm thực hành 10.3.4.1: Bệnh nhân viêm thận lupus tiến triển thành suy thận có thể được điều trị bằng chạy thận nhân tạo, thẩm phân phúc mạc hoặc ghép thận, và ghép thận được ưu tiên hơn là lọc máu lâu dài.
2 TÀI LIỆU THAM KHẢO
KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases

